Wetenschappers kunnen met menselijke cellen een model van een embryo maken om zo meer te leren over cruciale fases in de embryonale ontwikkeling.
Wat zou je ervan vinden als wetenschappers met menselijke cellen een model van een embryo maken? Om meer te leren over de ontwikkeling van bevruchte eicel tot foetus, om te achterhalen hoe genetische ziektes ontstaan, om bloed te leren maken, of om te bepalen waarom slechts 30 tot 60 procent van de bevruchte eicellen zich in de baarmoeder nestelt. Handig? Niet de bedoeling? Of zou je eerst meer willen weten voor je deze vraag beantwoordt?
De komende jaren volgen we op NEMO Kennislink verschillende wetenschappers die onderzoek doen aan dit soort embryo-modellen. Zij willen erachter komen hoe patiënten, wetenschappers, zorgverleners en andere burgers hierover denken. Welke status hebben ze, wat is het eigenlijk? Is het een klompje cellen of een mini-mens? Moeten we het wettelijk beschermen? Welke regels zouden moeten gelden voor dit soort onderzoek? We gaan in gesprek tijdens verschillende dialogen en doen hier verslag van. We schrijven achtergrondartikelen over het onderzoek en spreken allerlei experts.
Een van de fases waar de onderzoekers graag meer over willen weten is de periode in de embryonale ontwikkeling waarin cellen hun lot bezegeld krijgen. Ze worden huidcel of niercel. Spiercel of kliercel. Deze fase heet de gastrulatie.
Black box
Om onderzoek te doen naar de vroege stadia van de menselijke ontwikkelingen, kunnen wetenschappers embryo’s gebruiken die over zijn na een ivf-behandeling. De ouders kunnen deze aan de wetenschap doneren. Hoewel onderzoek met deze ‘restembryo’s’ heel nuttig is, kleven er ook nadelen aan. Zo zijn er relatief weinig beschikbaar. Bovendien mogen Nederlandse wetenschappers de embryo’s na veertien dagen niet meer in het lab in leven houden vanwege regels die in de Embryowet staan, terwijl dan de cruciale gastrulatiefase begint. Daarbij komt dat embryo’s in een ivf-traject ergens tussen dag 3 en 5 geplaatst worden. Hierdoor zijn ze op zijn jongst drie dagen oud en kunnen wetenschappers geen onderzoek doen naar dat allereerste begin.
Sommige ouders doneren een geaborteerd embryo aan de wetenschap. Omdat vrouwen vaak pas na een aantal weken weten dat ze zwanger zijn, zijn deze embryo’s meestal al minimaal 28 dagen oud. Wetenschappers mogen, mits de ouders hier toestemming voor geven, doorsneden maken om die eerste ontwikkelingen beter in beeld te brengen.
Van de periode tussen de 14 en 28 dagen, de gastrulatiefase, is hierdoor maar heel weinig bekend. Het wordt daarom ook wel de ‘black box’ van de embryonale ontwikkeling genoemd.
Miljoenen cellen
Om die black box toch te openen, zoeken wetenschappers in het laboratorium naar alternatieven voor natuurlijke menselijke embryo’s. Een van die alternatieven zijn dierlijke embryo’s. Onderzoekers gebruiken onder andere muizen om ons enig inzicht te geven in gastrulatie. Maar het gebruik ervan is beperkt, omdat dierlijke embryo’s zich anders kunnen gedragen dan menselijke embryo’s op het moment dat cellen gaan differentiëren in verschillende typen. “Als we mensspecifieke kenmerken willen begrijpen, moeten we echt naar een menselijk systeem kijken”, zei Naomi Moris, ontwikkelingsbioloog aan het Francis Crick Institute in Londen, vorig jaar tegen Nature
Daarom richten wetenschappers hun pijlen sinds een paar jaar op menselijke embryo-modellen. Zo’n model lijkt op een menselijk embryo, maar is niet helemaal hetzelfde. Ze heten daarom gastruloïden. Embryo’s in de gastrulatiefase heten gastrula’s en ‘oïde’ betekent ‘achtig’. De modellen zijn dus ‘gastrula-achtig’. In 2020 lukte het onderzoekers van de University of Cambridge en het Nederlandse Hubrecht Instituut voor het eerst om zo’n model te maken dat de gastrulatiefase van de mens nabootst. Ze gebruikten daarvoor humane embryonale stamcellen.
Die cellen komen oorspronkelijk uit een gedoneerd restembryo van een paar dagen oud. Het handige aan deze cellen is dat ze onsterfelijk zijn en makkelijk delen. “Van één embryo kun je miljoenen cellen krijgen”, legt stamcelonderzoeker Susanne van den Brink uit die bij het onderzoek betrokken was. “Die cellen kun je invriezen in buisjes en delen met andere mensen. Je hebt dus maar één keer een embryo nodig voor een nieuwe cellijn en daar kun je in principe een oneindige hoeveelheid stamcellen uithalen.” Embryonale stamcellen zijn pluripotent. Dat betekent dat ze nog in ieder celtype kunnen veranderen.

Om de gastruloïden te maken, plaatsen onderzoekers humane embryonale stamcellen in welletjes.
JoVE journal Open Access, Suzanne van den BrinkDe Engelse en Nederlandse onderzoekers plaatsten de embryonale stamcellen in plastic platen met allemaal putjes erin; welletjes genoemd. In ieder putje stopten ze tussen de 400 en 600 stamcellen en wat vloeistof. Van den Brink: “Door de plaat kort te centrifugeren, zinken de cellen naar de bodem, maar ze kunnen door de structuur van het putje niet aan de bodem vastplakken, dus ze klonteren aan elkaar en vormen een bolletje.”
Vervolgens voegden de wetenschappers chemische stoffen toe, waarna de celklompjes langer werden. Ze vormden een as van kop tot staart. Ook zagen de wetenschappers dat bepaalde genen werden aangezet. Dat gebeurde in specifieke patronen langs de lichaamsas van het model. Niet iedere cel zette dezelfde genen aan. Aangezien het DNA in vrijwel elke lichaamscel identiek is, kunnen verschillende celtypen alleen maar ontstaan doordat verschillende genen geactiveerd worden. Zo gaat het ook in een menselijk embryo. Door het verschil in genactivatie ontstaan later tijdens de ontwikkeling lichaamsstructuren zoals borstspieren, botten en kraakbeen.
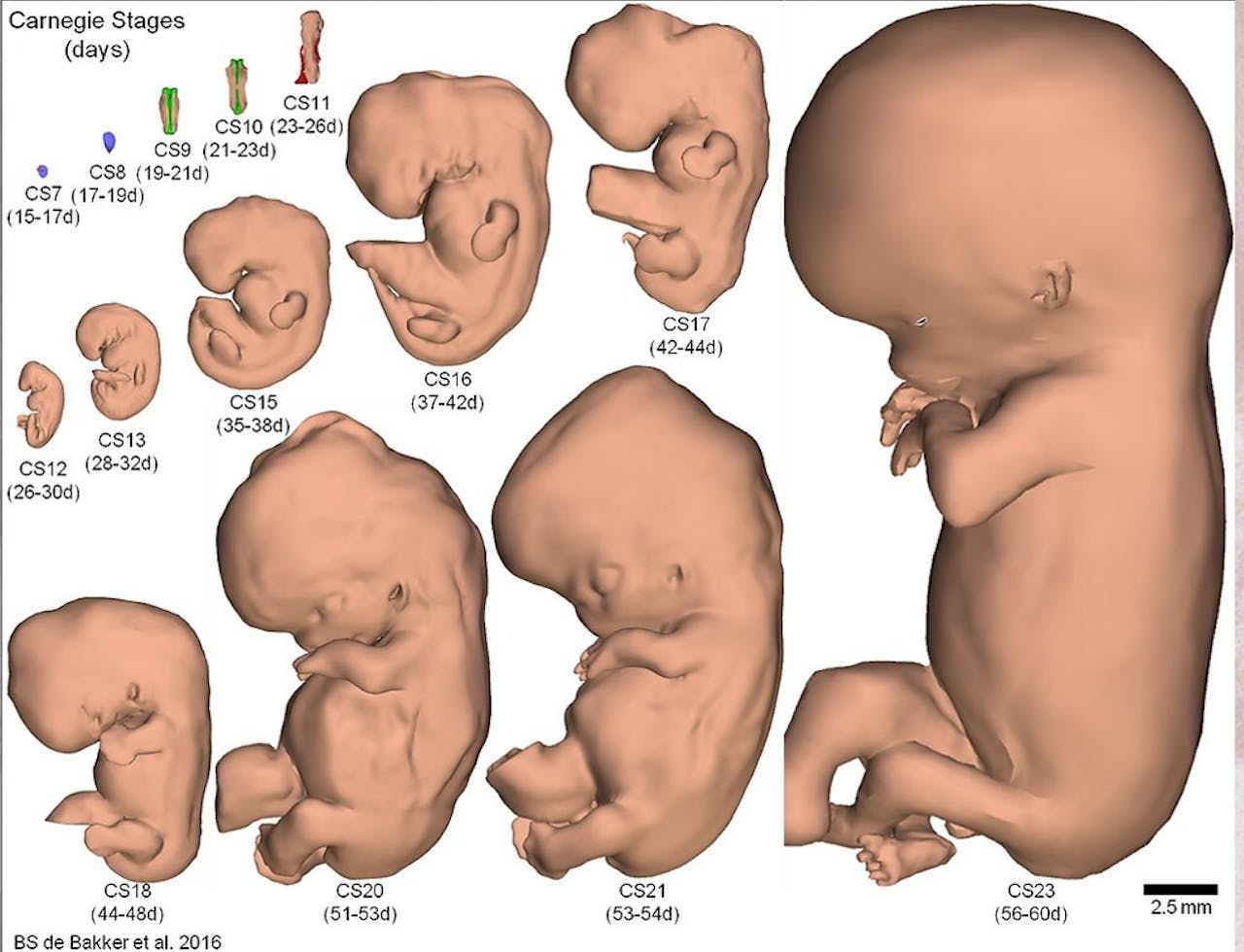
Om te bepalen of deze gastruloïden op menselijke embryo’s leken, vergeleken de wetenschappers ze met de Carnegie Collection of Embryology, een museumcollectie die menselijke embryo’s uit alle stadia van ontwikkeling bevat. Hieruit, en uit het genenpatroon dat ze zagen, concludeerden ze dat hun model qua vorm het meest lijkt op menselijke embryo’s van 18 tot 21 dagen oud. “De globale structuur komt overeen, we zagen duidelijk een kop-staart as, maar de microstructuren zijn nog niet hetzelfde”, zegt Van den Brink.
Vergelijkbaar maar toch anders
Een van de dingen die ontbraken zijn somieten. Normaal worden deze blokjes mesoderm tijdens de gastrulatie aangelegd. Hieruit ontstaan later de wervelkolom, de ribben, een deel van de huid en de rugspieren. Het aantal somieten langs de lichaamsas zegt iets over de leeftijd van het embryo. De eerste somieten ontstaan tussen dag 18 en 20 in menselijke embryo’s.
“In ons model zagen we wel cellen die somieten kunnen vormen, maar die blokstructuur ontstond niet.” Bovendien ontstond er geen notochord; mesodermaal weefsel waaruit de tussenwervelschijven ontstaan. “Waarom dat zo is, weten we niet”, zegt Van den Brink.
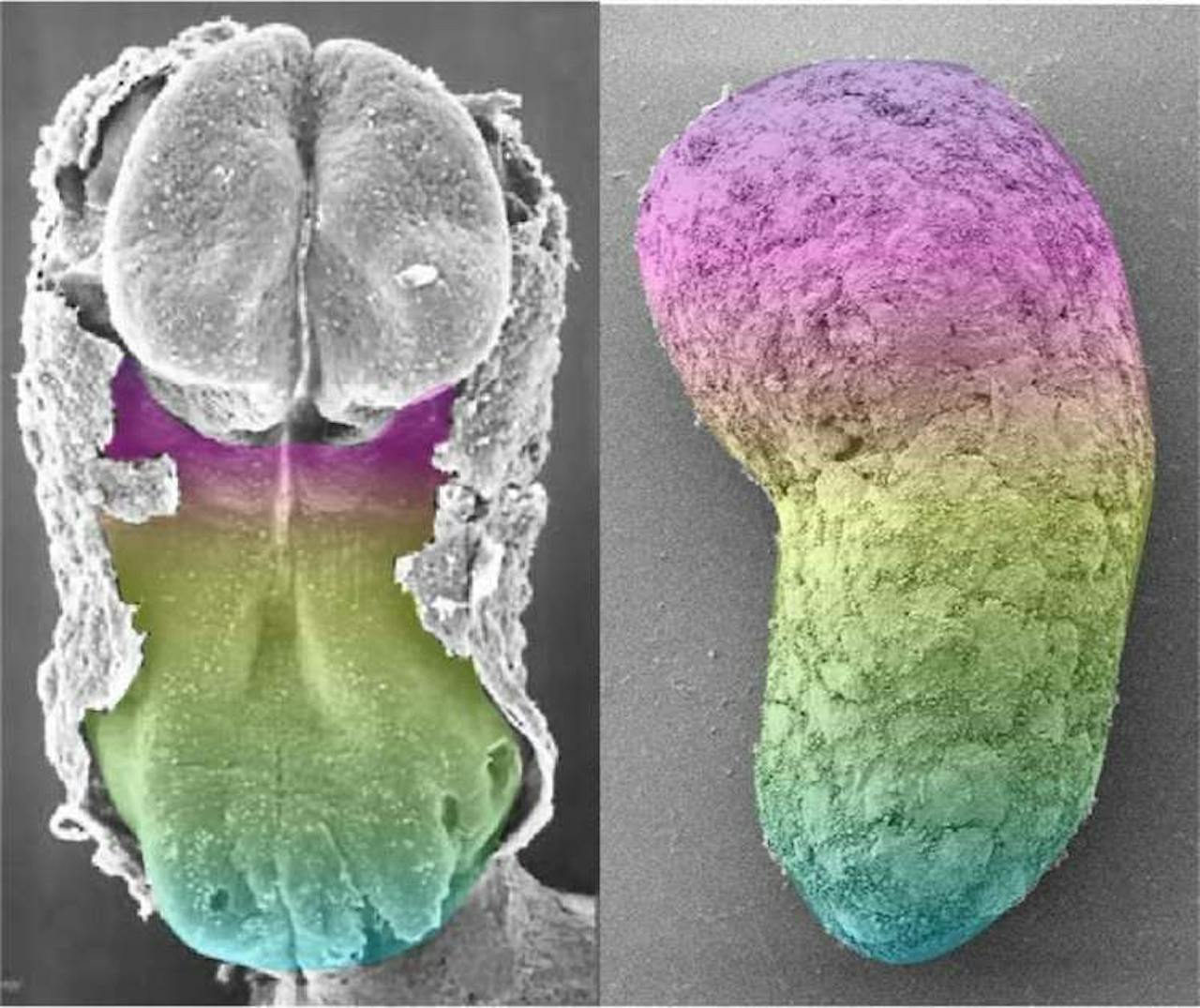
Een vergelijking tussen een 20 dagen oud menselijk embryo, links, en het embryo-model, rechts. De globale structuur komt overeen, maar de microstructuur niet. Dit is een extreme vergroting. In werkelijkheid is het model rechts 0,3 mm groot.
Naomi Morris en Kathy Sulik, University of Cambridge en University of North CarolinaEen ander wezenlijk verschil is dat het model geen hersenen kon vormen. Op het moment dat de cellen de welletjes in gingen, voegden de wetenschappers een molecuul toe dat vorming van hersenen remt. Daarnaast misten ze de cellen die nodig zijn om het embryo in de baarmoeder te laten innestelen. Er kon geen placenta ontstaan.
Dat is mogelijk de reden waarom gastruloïden tot nu toe niet veel langer dan een paar dagen in leven blijven. Waarschijnlijk krijgt de structuur op een bepaald punt te weinig zuurstof. Bij de menselijke ontwikkeling neemt de placenta die functie over.
“Dit soort onderzoek is ontzettend spannend omdat zo weinig bekend is over deze fase”, zegt Van den Brink die nog steeds werkt aan gastruloïden, maar inmiddels aan het IMIM-instituut in Barcelona. “Wij bootsen het stadium na dat heel moeilijk met echte embryo’s te onderzoeken is. Vrijwel niemand heeft eerder naar deze fase van de menselijke ontwikkeling kunnen kijken.” Het grote nadeel is dat de onderzoekers daarom weinig vergelijkingsmateriaal hebben. “Bij een muismodel kun je makkelijk in een echt muizenembryo onderzoeken op welke punten ze verschillen. Bij humane gastruloïden is dat veel lastiger.”
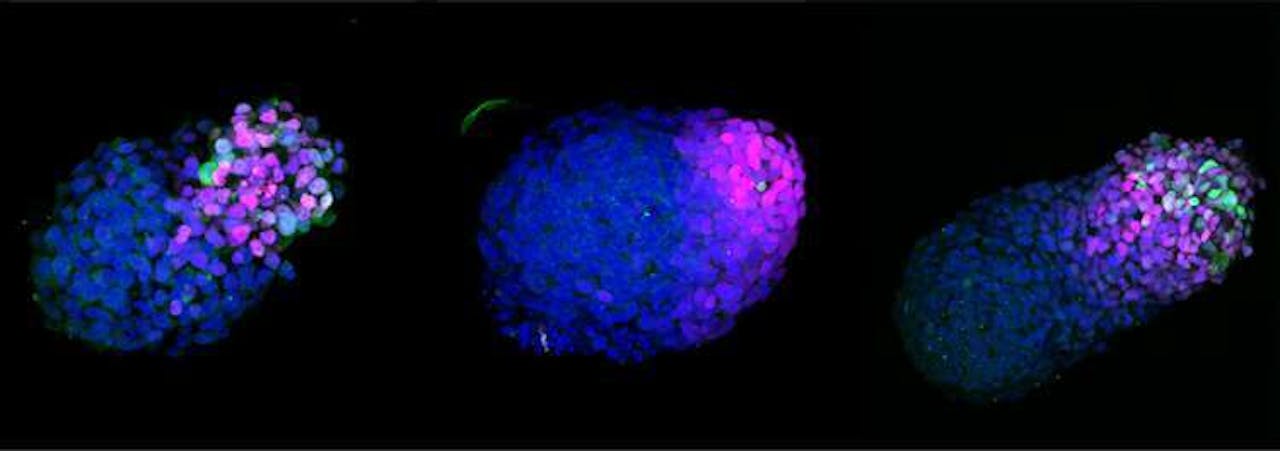
Een groeiend menselijk embryo-model 24 uur, 48 uur en 72 uur nadat de cellen in de welletjes zijn gegaan.
Naomi Morris, University of CambridgeNaast modellen die de gastrulatie nabootsen, zijn er dierlijke embryo-modellen die lijken op embryo’s in de blastulafase (zie kader ‘Van bevruchting tot foetus bij mensen’): de fase voordat het embryo zich in de baarmoeder nestelt. Andere omvatten weefsels die het embryo omringen, zoals de dooierzak en de vruchtwaterholte. En weer andere moeten de vroege stappen van de hersenvorming, het ruggenmerg en het hart nabootsen, die plaatsvinden rond dag 22 van het embryo. Er zijn nog geen menselijke modellen die deze fases nabootsen.
Op NEMO Kennislink zullen we de ontwikkelingen van deze modellen de komende tijd nauwgezet volgen en zullen we daarnaast verder ingaan op de ethische aspecten van dit soort onderzoek.