Met embryo-modellen kunnen wetenschappers onderzoeken hoe ziektes ontstaan en mogelijke medicijnen hiervoor testen.
In Nederland leven zo’n tweeduizend mensen met de spierziekte FSHD. Bij deze aandoening verliezen de spieren steeds meer kracht, waardoor mensen uiteindelijk in een rolstoel kunnen belanden. Momenteel is er geen medicijn voor FSHD. Patiënten krijgen medicijnen om hun symptomen te verlichten, maar die kunnen de ziekte niet remmen. De spierzwakte begint meestal in het gezicht, de schouders en bovenarmen als patiënten tussen de tien en twintig jaar oud zijn. Hoe de ziekte precies ontstaat, waarom de symptomen pas op latere leeftijd opkomen en waarom juist in het hoofd-halsgebied, willen wetenschappers uitzoeken met behulp van embryo-modellen.
Er bestaan verschillende embryo-modellen voor verschillende fasen van de embryonale ontwikkeling. Zo bootst een gastruloïde de gastrulatie na; de fase waarin cellen hun lot bezegeld krijgen. Ze worden bijvoorbeeld huidcel of spiercel. Dat model ziet eruit als een uitgerold hompje klei. Het vormt duidelijk een lichaamsas met twee verschillende uiteinden: een kop en een staart en een duidelijke buik- en rugzijde. Wetenschappers gebruiken deze modellen om de eerste weken van de embryonale ontwikkeling goed te onderzoeken, want hier is nog weinig over bekend.
Naast dit fundamentele onderzoek, kunnen embryo-modellen gebruikt worden voor meer toepassingsgericht onderzoek. Zo hopen onderzoekers hiermee de oorzaken van spierziektes als FSHD te achterhalen, of van hartaandoeningen.
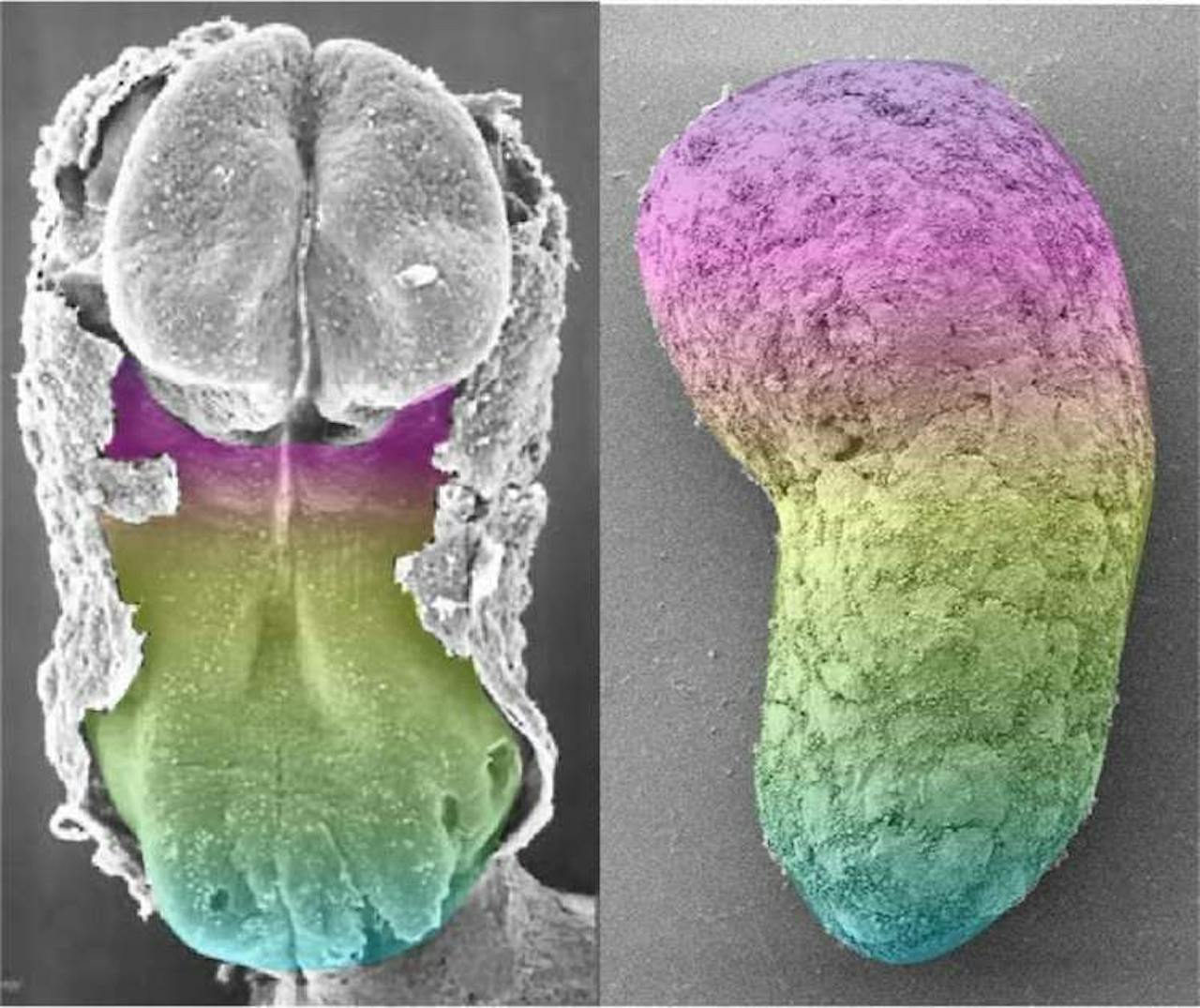
Een vergelijking tussen een twintig dagen oud menselijk embryo (links) en het embryomodel (rechts).
Naomi Morris en Kathy Sulik, University of Cambridge en University of North CarolinaLastig onderzoek
“FSHD is een aandoening waarbij in iedere lichaamscel een genetische fout zit die kan leiden tot deze ziekte”, legt Niels Geijsen uit. Hij is hoogleraar Ontwikkelingsbiologie en Regeneratieve geneeskunde van het Leids Universitair Medisch Centrum. “Het gekke is dat met name de spieren van het gezicht, hals, schouders en bovenarmen zijn aangedaan. Andere skeletspieren, die dus hetzelfde DNA-foutje in hun cellen hebben, zijn veel minder aangedaan. Hoe komt dat?”
“Een mogelijke verklaring is dat bij alle embryo’s de voorlopercellen van de spieren in het gebied dat later het hoofd gaat worden, anders zijn dan de voorlopercellen van spieren elders in het embryo.” Om te kijken of die hypothese klopt, willen de onderzoekers die voorlopercellen onderzoeken in gezonde humane embryo-modellen.
Het kan zo zijn dat die verschillende voorlopercellen geen gevolg hebben bij gezonde mensen, maar wel bij FSHD-patiënten. Wat er tijdens de gastrulatie anders gaat bij patiënten met FSHD, willen onderzoekers in een later stadium bekijken bij zieke embryo-modellen met FSHD. De ziekte komt alleen voor bij mensen en andere primaten en dat maakte onderzoek tot nu toe lastig. Er zijn geen diermodellen zoals ratten of muizen beschikbaar. Humane embryo-modellen kunnen een uitkomst bieden.
Simpel, maar robuust model
Geijsen en collega’s gebruiken een bijzonder type model: een somatoïde (somiet-achtig) genoemd. Het is een eenvoudige versie van de gastruloïde. Er is geen endoderm dat normaal gesproken de interne organen zoals longen, lever en darmen vormt en slechts een klein beetje ectoderm waaruit huidcellen en zenuwcellen kunnen ontstaan. In tegenstelling tot bij de gastruloïde, lukt het hier heel goed om somieten te vormen (zie ook artikel 1 van dit drieluik). “We zien ze achter elkaar als een soort trein met verschillende wagons ontstaan”, zegt Geijsen.
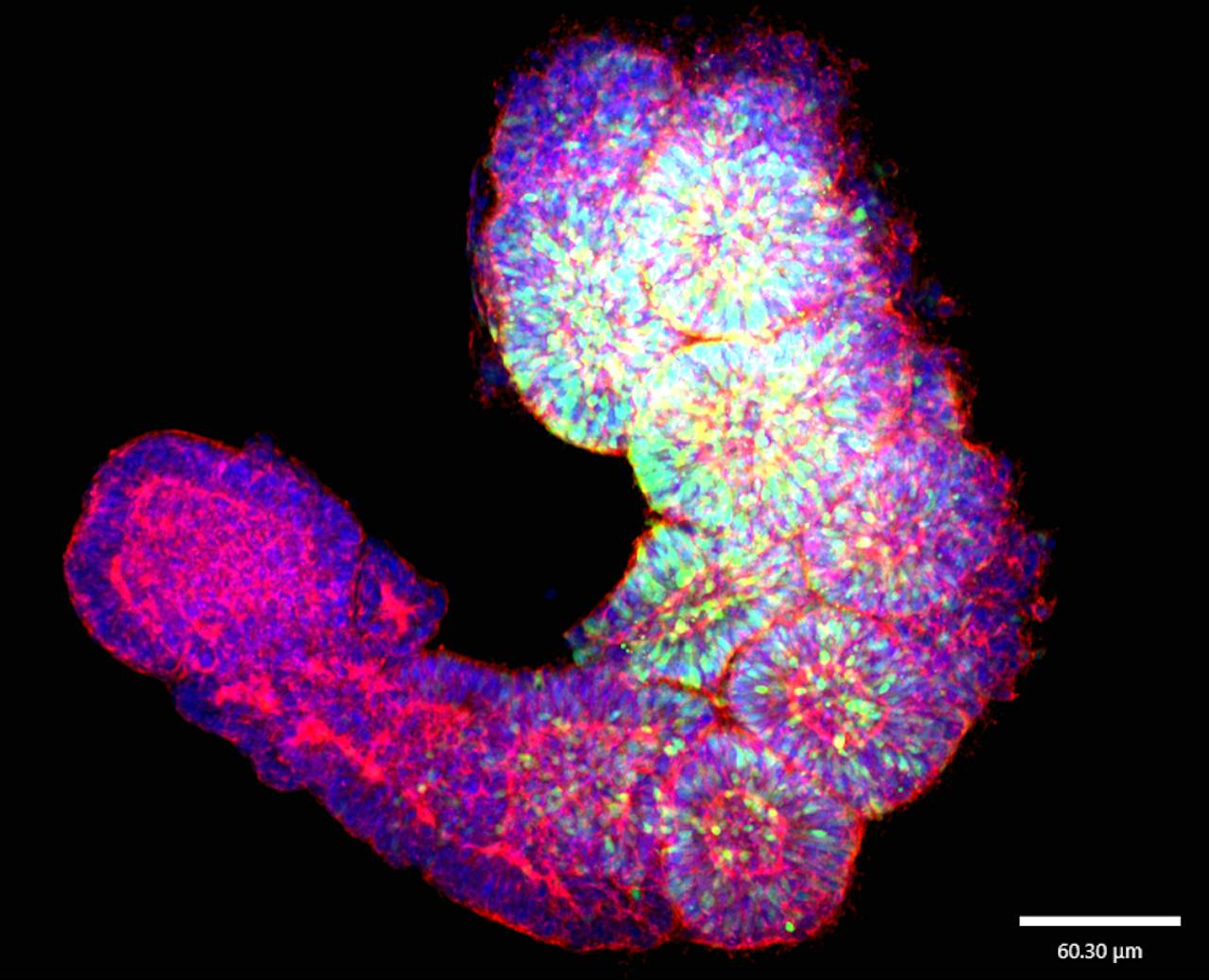
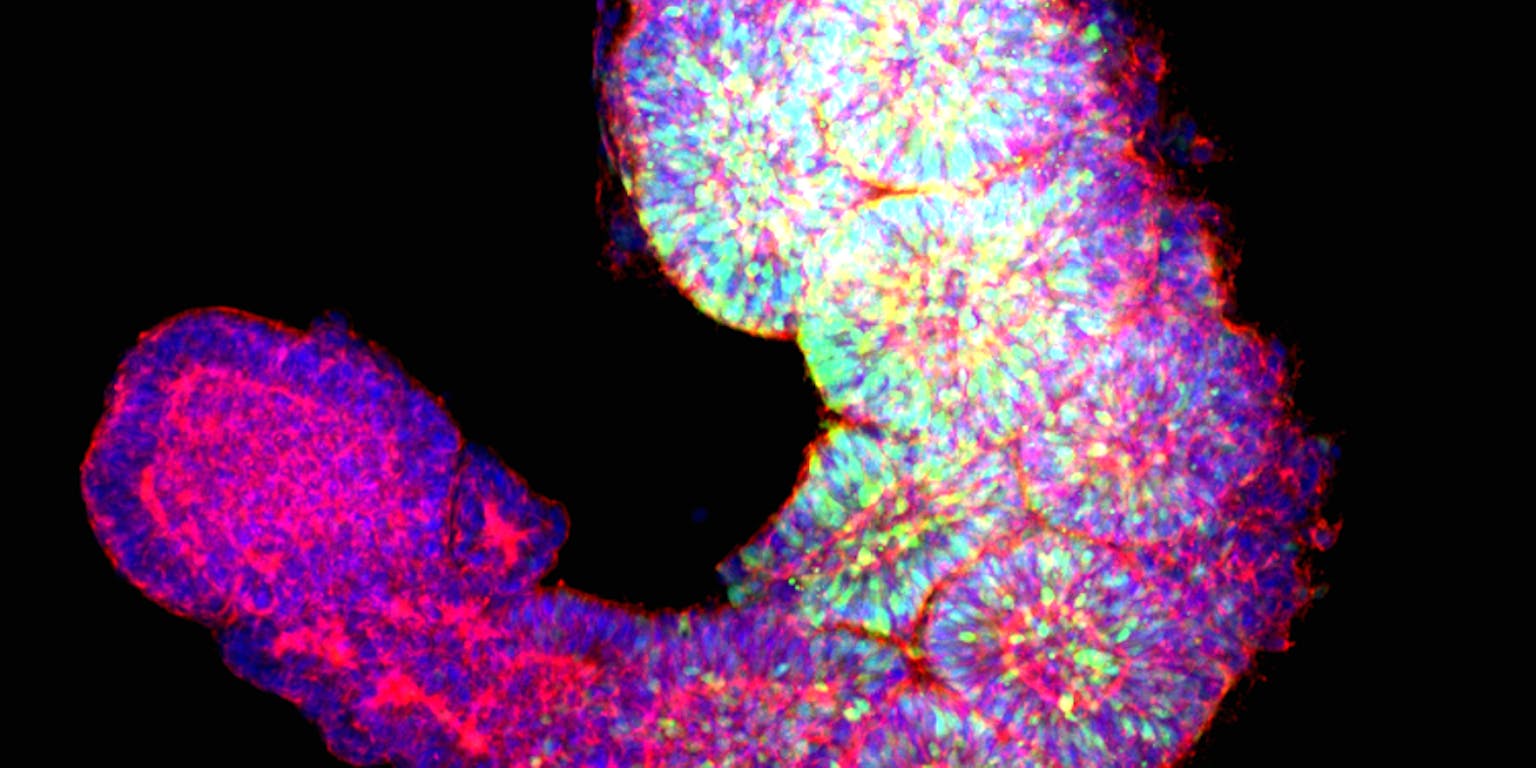
Met somatoïdes hopen onderzoekers te ontrafelen wat er misgaat bij een spierziekte als FSHD.
Mehmet Yildiz, Geijsen labSomieten zijn embryonale structuren die later in de ontwikkeling de wervelkolom, de ribben, een deel van de huid en spieren vormen. Geijsen: “Dat is precies het deel wat wij willen onderzoeken. Hierdoor is het een simpel, maar heel robuust model en dat is voor deze beginfase van het onderzoek perfect.” Ook bij dit model kunnen er geen hersenen worden gevormd en de levensduur is – net als bij menselijke gastruloïden – ongeveer een week.
Niet alleen willen ze kijken of de voorlopercellen in de verschillende gebieden anders zijn, ze willen ook in de cellen kijken of de genen die aan of uit staan verschillen. Geijsen: “Dat kunnen we per cel bekijken en die informatie koppelen we aan de locatie van de cel.” Ook dit wisselende genenpatroon kan een reden zijn waarom de ziekte in bepaalde lichaamsdelen sterker tot uiting komt.
Heilige graal
Ook voor aangeboren hartafwijkingen of bloedziektes kunnen embryo-modellen interessant zijn. “De heilige graal is om transplanteerbare bloedstamcellen te kunnen maken”, zegt Geijsen. Uit deze bloedstamcellen ontstaan rode bloedcellen, witte bloedcellen en bloedplaatjes. Bij een beenmergtransplantatie krijgt een patiënt bloedstamcellen. “Als het zou lukken deze in het lab te maken, kunnen we bijvoorbeeld voor kankerpatiënten die een beenmergtransplantatie nodig hebben, in het lab hun eigen bloedstamcellen maken.”
Een andere stip op de horizon is onderzoek naar nieuwe medicijnen. Als embryo-modellen geschikt blijken om bepaalde ziektes na te bootsen, kunnen onderzoekers het effect van medicijnen op het ontstaan van de ziekte onderzoeken.
Bij veel erfelijke aandoeningen zit de genetische fout niet bij alle patiënten op dezelfde plek. Hierdoor kan het zo zijn dat niet ieder toekomstig medicijn bij iedereen even goed aanslaat. “Stel dat die fout op vijftig verschillende plekken in het gen kan zitten. Je zou dan van de vijftig verschillende mutaties een embryo-model kunnen maken en hierop de medicijnen kunnen testen om te kijken wat het beste voor welke variant werkt.” Voor iedere patiënt bepaal je dan welke van de vijftig mutaties hij heeft, en welk medicijn het beste bij hem past. “Dit soort geneesmiddelen zijn vaak heel duur en geneesmiddelen zijn nooit zonder bijwerkingen. Als je kunt voorspellen dat een middel niets gaat doen kun je de patiënt een hoop ellende besparen.”