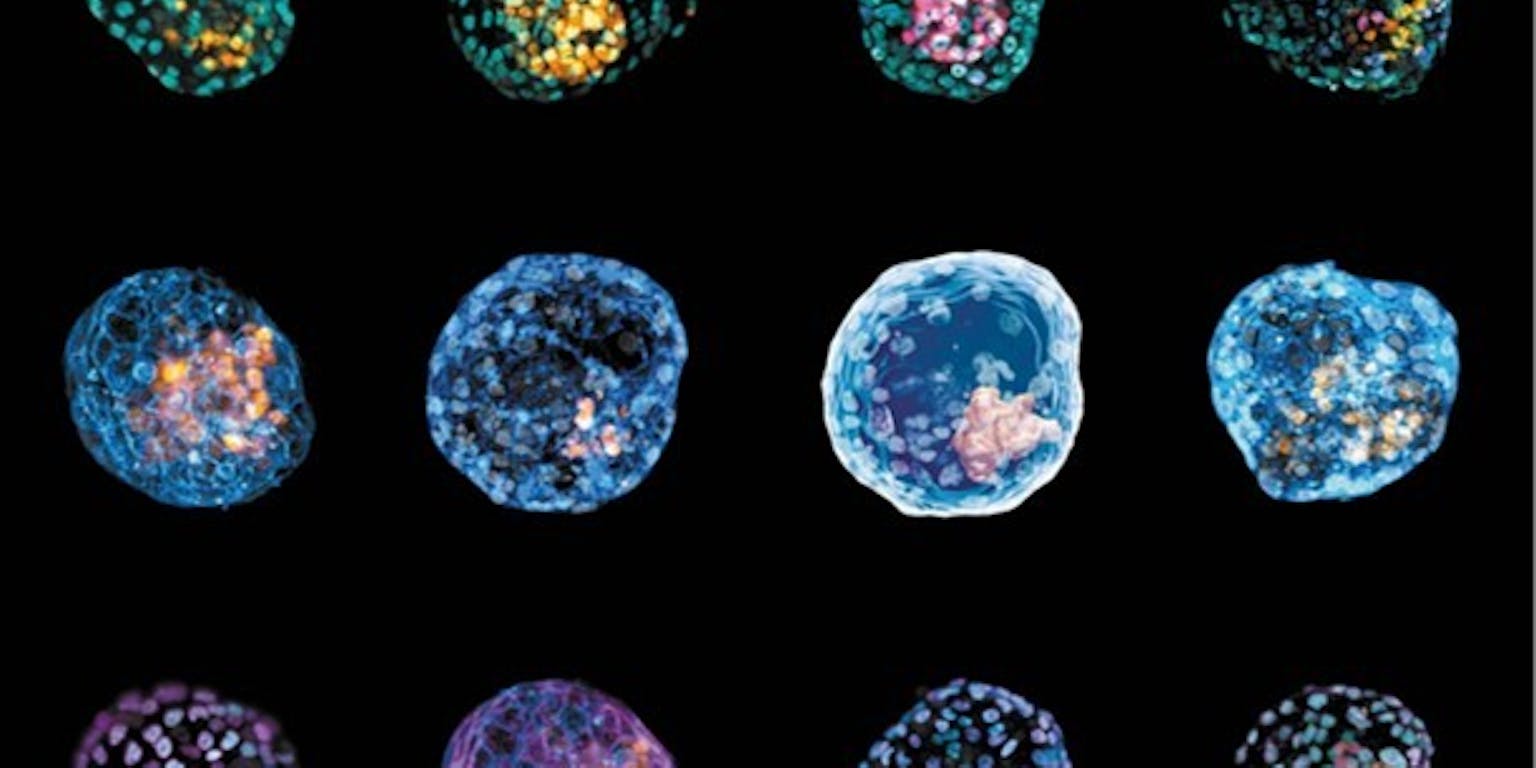
Met embryo-modellen kunnen wetenschappers de vroege embryonale ontwikkeling onderzoeken. Wat heeft dit jonge onderzoeksveld al opgeleverd?
Om embryo’s in een lab te maken, moet je cellen vooral niet te veel ruimte geven. Dat ontdekte Nicolas Rivron in 2018 toen hij in het Hubrecht Instituut in Utrecht een paar embryonale stamcellen van een muis in een klein holletje stopte met wat trofoblaststamcellen. Normaal gesproken vormen trofoblaststamcellen tijdens de ontwikkeling de placenta. Maar nu vormde zich spontaan een bolletje dat veel op de beginfase van een embryo leek: de blastulatie.
Nadat hij het bolletje, ook wel blastuloïde genoemd, in de baarmoeder van een muis plaatste, nestelde die zich in het baarmoederslijmvlies en groeide verder. Na een paar dagen stopte het embryo-model met groeien. Vermoedelijk kwam dit doordat hij niet genoeg voeding kreeg. Normaal krijgt een embryo tijdens de vroege embryonale ontwikkeling voeding uit de dooierzak totdat de placenta die taak overneemt. De cellen die de dooierzak vormen, ontbraken in dit experiment.
Het experiment was een grote doorbraak in het onderzoek naar de vroege embryonale ontwikkeling, waarover nog weinig bekend is. Met blastuloïden hopen wetenschappers onder andere te ontdekken welke genen bij een embryo cruciaal zijn voor een goede innesteling. Dertig tot zestig procent van de zwangerschappen gaat fout bij de innesteling. Hoe dat kan, is nog niet bekend.
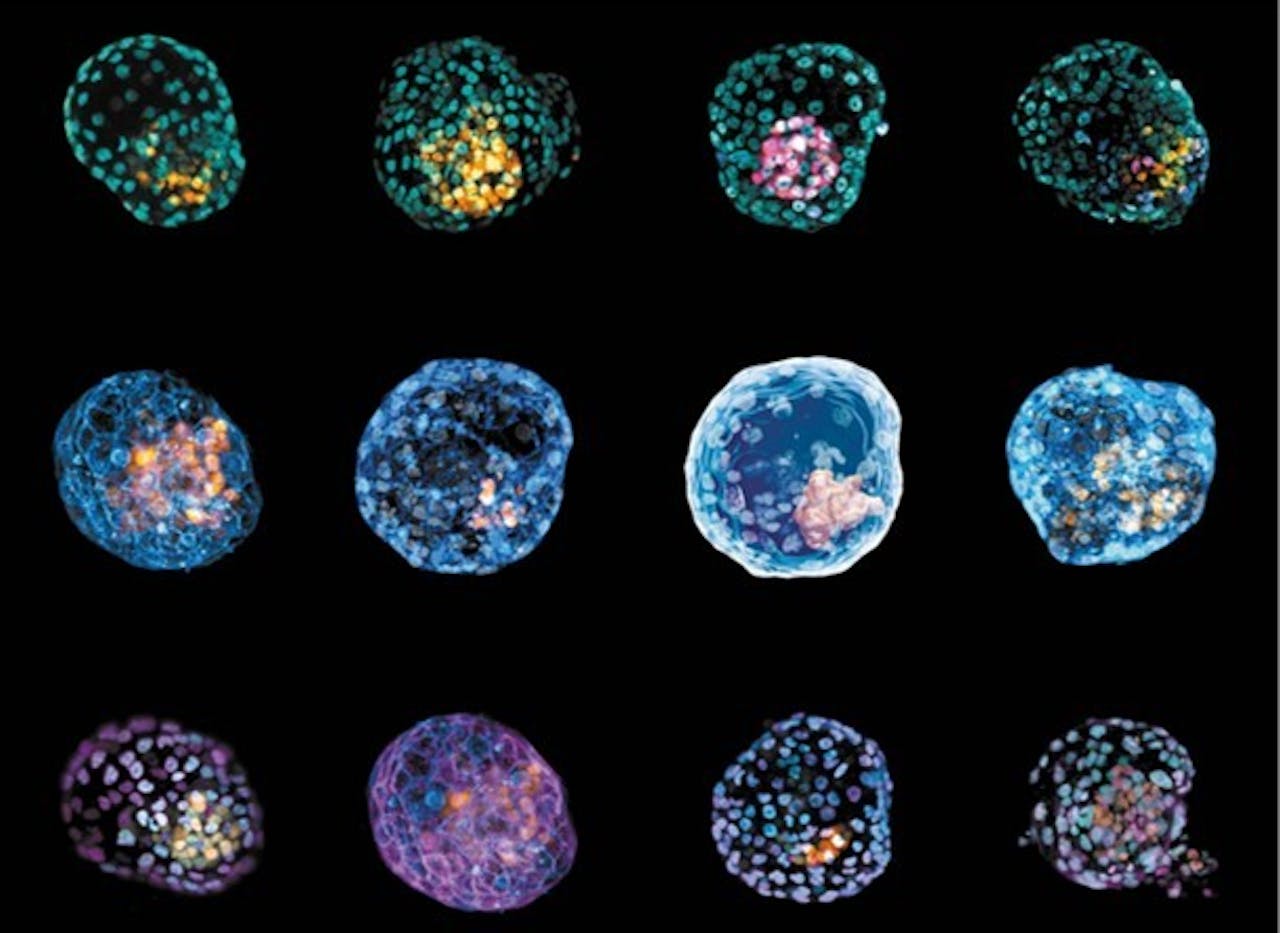
Humane embryo-modellen die de blastulatie nabootsen. Deze blastuloïden zijn gemaakt van menselijke huidcellen die teruggeprogrammeerd zijn naar stamcellen.
Monash UniversityHet muizenonderzoek van Rivron zorgde ervoor dat meerdere onderzoeksteams probeerden om blastuloïden van menselijke stamcellen te maken. In 2021 lukte dat verschillende onderzoeksteams, ook in Nederland. Deze modellen plaatsten de onderzoekers niet terug in baarmoeders, ze lieten ze in het lab een paar dagen groeien.
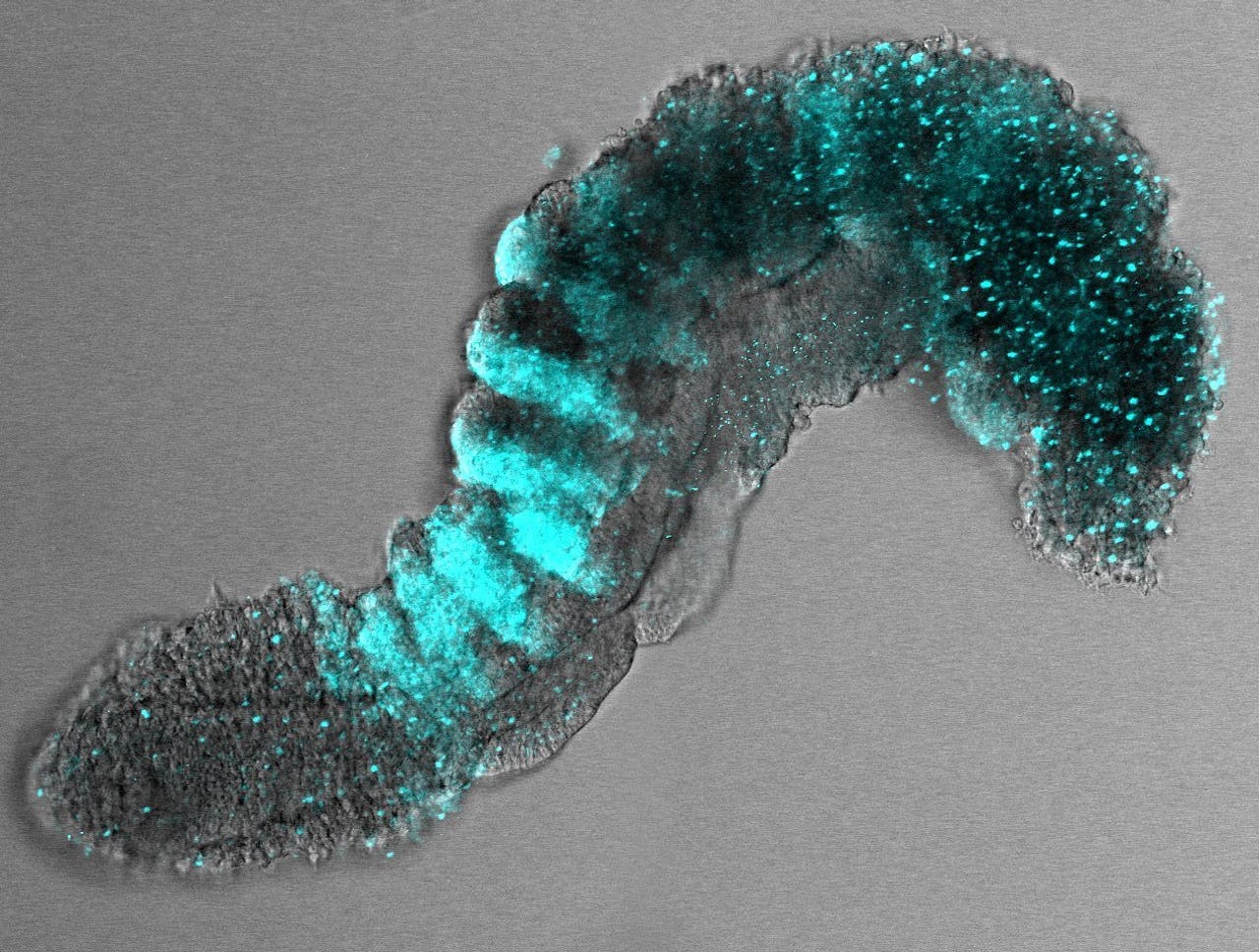
Op deze afbeelding zie je een muis-gastruloïde van een paar dagen oud met somieten, de blokjes mesoderm waaruit onder andere de spieren ontstaan. In blauw is het achterste deel van de somieten ingekleurd.
Vincent van Batenburg en Susanne van den Brink, Cambridge University, Nature 2020Hoe vergelijkbaar dit soort embryo-modellen zijn met menselijke embryo’s, en hoe nuttig ze dus zijn, moet nog worden bepaald. Dat is niet altijd even makkelijk, juist omdat er zo weinig over die eerste fases van embryonale ontwikkeling bekend is. Hoe groter de gelijkenis, hoe groter de technische en ethische uitdagingen.
Duidelijk is wel dat dit soort modellen een scala aan nieuwe onderzoeken mogelijk maken. Zo kunnen wetenschappers erfelijke ziektes onderzoeken en potentiële medicijnen testen op structuren die veel op een embryo lijken.
Van kop tot staart
Dat laatste type onderzoek zal waarschijnlijk vooral met gastruloïden gebeuren; modellen die de gastrulatiefase nabootsen die tussen de twee en vier weken na de bevruchting plaatsvindt. Hierin ontstaat de blauwdruk voor het lichaam dat laat zien waar het hoofd komt en waar de staart. En er ontstaan drie kiemlagen: het endoderm dat de inwendige organen en darm vormt, het mesoderm waaruit spier- en bindweefsel ontstaan en het ectoderm dat voor de huid en het zenuwstelsel zorgt. Deze lagen zijn de voorlopers van alle organen en celtypen.
De eerste gastruloïden van een muis werden in 2014 aan de Rockefeller University in New York gemaakt. Maar dit waren nog 2D-structuren. Het was onderzoeker Susanne van den Brink, die toen aan de University of Cambridge werkte, die de eerste 3D-modellen maakte die deze periode bij de muis nabootsen. “Toen zagen we voor het eerst een kop-staart-as, de rug-buik-as en de links-rechts-as, alle orgaanvoorlopers op de juiste locatie”, zegt van den Brink. Tot die tijd dachten onderzoekers dat embryo’s om die kop-staart-as te vormen, signalen moesten ontvangen uit de cellen die de dooierzak en de placenta vormen. Gastruloïden missen die cellen. Het was een belangrijke ontdekking dat die as ook zonder de aanwezigheid van die cellen gevormd wordt.
Zes jaar later, in 2020, lukte het Van den Brink om muismodellen te ontwikkelen die somieten vormen. Dit zijn blokjes mesoderm waaruit later de wervelkolom, de ribben, een deel van de huid en de rugspieren ontstaan. Bij de eerdere modellen ontbraken die. Al deze muismodellen kunnen zich, in tegenstelling tot de blastuloïden, niet in een baarmoeder innestelen omdat de cellen die de placenta en dooierzak vormen, ontbreken.
In datzelfde jaar ontwikkelden Van den Brink en collega’s de eerste menselijke gastruloïden. Die zijn nog niet zo ver als het muismodel, er ontstaan bijvoorbeeld geen somieten. “Maar wereldwijd vindt veel onderzoek plaats, dus het zal niet lang meer duren totdat het eerste menselijke embryo-model met somieten er is”, zegt Niels Geijsen, hoogleraar Ontwikkelingsbiologie en Regeneratieve geneeskunde van het Leids Universitair Medisch Centrum.
Snelle ontwikkelingen
Dat de ontwikkelingen snel gaan, bleek deze zomer toen onderzoekers uit onder andere Cambridge en California erin slaagden om voor het eerst embryo-modellen van muizen te maken met aanleg tot hersenen, een kloppend hart en geslachtscellen. De onderzoekers gebruikten daarvoor verschillende soorten stamcellen, die embryo, trofoblast en dooierzak vormden. Ze lieten het embryo-model in het lab groeien.
“Fascinerend dat dit mogelijk was zonder tussenkomst van baarmoeder”, zegt Geijsen, die in zijn lab een spierziekte met embryo-modellen onderzoekt. “Het roept de vraag op hoe ver je kunt en moet gaan. Niemand heeft dit nog met humane cellen geprobeerd maar dat is zeker mogelijk. Het is alleen een technisch probleem dat ongetwijfeld iemand ter wereld binnen een paar jaar op zal lossen.”
“Op mijn afdeling is het heel recent gelukt om een muizenembryo-model te maken met voorlopercellen van geslachtscellen en bloedcellen”, zegt Joost Gribnau, hoogleraar Ontwikkelingsbiologie in het Erasmus MC. “Het wetenschappelijke artikel is net geaccepteerd en zal binnenkort verschijnen.” De ontwikkelingen gaan volgens hem erg snel. “Dat is niet ongewoon voor een vakgebied dat zoveel op kan leveren qua kennis. We hebben nu redelijk onder de knie hoe we deze modellen moeten maken. Ik verwacht dat we de komende jaren steeds beter leren hoe we ze kunnen gebruiken om genetische aandoeningen te onderzoeken. Tot op heden konden we, door de beperkingen van de Embryowet, nauwelijks onderzoek doen naar die cruciale beginfase. Nu kan dat eindelijk en dan kan het snel gaan.”
Of de Nederlandse bevolking achter het onderzoek staat, is daarbij voor Gribnau essentieel. “En dat geldt ook voor mijn collega-onderzoekers, daar ben ik van overtuigd. Als burgers vinden dat we dit niet moeten doen, moeten we het niet doen. Aan ons is de taak om de maatschappij te overtuigen van het belang van dit soort modelsystemen.” Gribnau zou graag zien dat we de discussie op mondiaal niveau voeren, hoe moeilijk dat ook is. “Ik hoop dat we in die discussies mensen vooruit kunnen laten kijken. Want stel dat we nu in Nederland besluiten dit onderzoek niet toe te staan, en we zien over tien jaar de grote voordelen die andere landen hiervan ondervinden door het wel toe te staan, dan ben je te laat. Het kost je minimaal tien jaar om een onderzoeksveld nieuw leven in te blazen.”