Zowel de chemische industrie als de natuur kunnen niet zonder katalysatoren. Die uit de natuur werken heel goed en zijn duurzaam – dat wil de industrie ook wel. Groningse chemici publiceerden in Nature Chemistry een nieuwe manier om natuurlijke katalysatoren, de enzymen, te ontwerpen met niet-natuurlijke bouwstenen.

Deel van een chemische fabriek op het Chemie Park in Delfzijl. Veel processen in de chemische industrie zijn afhankelijk van katalysatoren om de reactiestappen sneller te laten verlopen.
Gouwenaar via Wikimedia Commons, publiek domeinChemische reacties verlopen lang niet altijd vlotjes. Heel vaak hebben moleculen een zetje nodig om samen een nieuwe stof te vormen. Dat zetje geven katalysatoren: stoffen die een chemische reactie versnellen, maar zelf niet reageren. De chemische industrie kan niet zonder katalysatoren, maar ook in de natuur verlopen de gewenste reacties meestal niet vanzelf. Levende cellen beschikken daarom over een uitgebreide collectie katalysatoren die we enzymen noemen.
Enzymen zijn eiwitten; grote biomoleculen waarvoor de bouwinstructies opgeslagen liggen in het DNA van de cel. Er zijn ontzettend veel verschillende enzymen die ieder heel specifiek een chemische reactie uitvoeren en dat ongelooflijk goed doen. Zo goed, dat de chemische industrie hier met enige afgunst naar kijkt.
Industriële katalysatoren zijn heel efficïent, maar bevatten vaak kostbare, giftige en/of zeldzame metalen. Bovendien vreten de productieprocessen veel energie, omdat er ook een hoge temperatuur, en soms een hoge druk, nodig is. Tot slot zijn er speciale oplosmiddelen nodig die zorgen voor moeilijk verwerkbare afvalstromen. Een groot contrast met enzymen. Die werken juist onder heel vriendelijke, milde omstandigheden. Denk maar aan je eigen lichaam waar talloze enzymen hun werk doen. Geen vervuilende oplosmiddelen, maar water. Geen hoge temperatuur, maar iets rond de 37 graden. En alleen maar ‘groen’ afval.
Enzym ontwerpen
Geen wonder dat de chemische industrie enzymen graag als katalysator zou gebruiken. Maar dan loop je meteen tegen een probleem aan. Er zijn alleen enzymen beschikbaar voor reacties die in de natuur plaatsvinden, terwijl in de industrie niet-natuurlijke reacties ook een grote rol spelen.
De oplossing? Nieuwe enzymen ontwerpen. Kunstmatige enzymen, die de kracht en de groene werkwijze van natuurlijke enzymen combineren met de vindingrijkheid van chemici om ieder gewenst molecuul te kunnen maken. Er zijn verschillende manieren om kunstmatige enzymen te maken. NEMO Kennislink schreef eerder al over het gebruik van synthetische hulpstoffen om natuurlijke enzymen te verbeteren en over de gestuurde evolutie van enzymen om ze niet-natuurlijke reacties te laten uitvoeren. Maar in beide gevallen is een bestaand enzym het uitgangspunt, waar je iets aan probeert te veranderen.
Niet-natuurlijke bouwstenen
Gerard Roelfes pakt het ontwerp van enzymen anders aan. Roelfes is hoogleraar biomoleculaire chemie aan de Rijksuniversiteit Groningen en in Nature Chemistry publiceerde zijn groep het ontwerp van een nieuw enzym op basis van een ‘gewoon’ eiwit, waar ze een niet-natuurlijk aminozuur hebben ingezet. Eiwitten, en dus ook enzymen, bestaan uit een lange keten van aan elkaar gekoppelde aminozuren – waarvan er in de natuur twintig verschillende zijn – in een specifieke volgorde. Door iets te veranderen in die keten, kun je de eigenschappen van het eiwit veranderen.
“Enzymen moeten het in de natuur doen met de twintig beschikbare aminozuren en dat is niet genoeg om alle reacties uit te kunnen voeren die nodig zijn in een levende cel’, zegt Roelfes. “Gedurende de evolutie zijn daar oplossingen voor ontstaan, zoals het gebruik van hulpstoffen, de cofactoren. Of nadat het enzym is gemaakt in de cel, vinden er nog chemische toevoegingen plaats. Aan sommige aminozuren in de keten wordt nog een extra stukje geplakt, waardoor het enzym een andere reactie kan uitvoeren.” Er ontstaat in feite een nieuw aminozuur.
Die oplossing van de natuur inspireerde Roelfes om uit te zoeken of je met een niet-natuurlijk aminozuur een gewoon eiwit, dat niks katalyseert, kunt omtoveren in een enzym. Want niet-natuurlijke aminozuren zijn er volop, die hebben chemici al in allerlei varianten gemaakt. Maar waarom begint hij niet met een bestaand enzym, dat is toch veel eenvoudiger? “Nee, want bestaande enzymen werken heel specifiek. Ze zijn helemaal geëvolueerd om alleen die ene reactie met die specifieke moleculen uit te voeren. Als je ze iets anders wilt laten doen, moet je het hele enzym ombouwen. Dat is niet handig. Wij zoeken daarom naar een eiwit dat je als basis kunt gebruiken om veel verschillende enzymen te ontwerpen.”
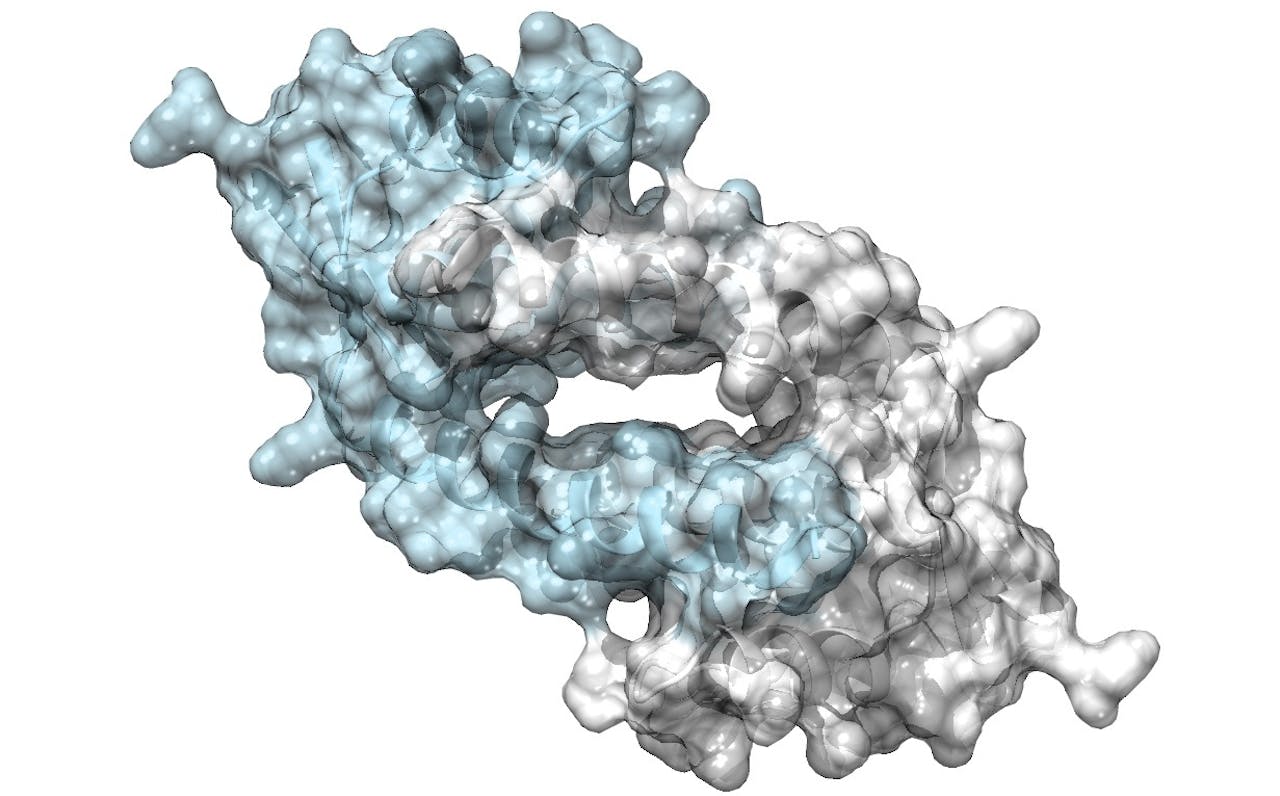
Weergave van de structuur van het LmrR-eiwit. Twee LmrR moleculen (blauw en grijs) vormen samen een grotere structuur met een holte in het midden. Die holte is zeer geschikt voor het binden van verschillende moleculen en levert zo een lokale omgeving met andere omstandigheden dan daarbuiten. Ideaal voor het uitvoeren van chemische reacties.
Clemens Mayer, RuG via EurekAlert.orgDonut
De keuze viel op het eiwit LmrR, dat gemaakt wordt door een melkzuurbacterie. “Dit eiwit is heel geschikt vanwege de vorm”, legt Roelfes uit. “Twee eiwitmoleculen vormen samen iets wat op een donut lijkt. Die holte biedt een goede omgeving voor moleculen die niet van water houden, zogeheten hydrofobe moleculen. En veel van de stoffen waar wij in zijn geïnteresseerd zijn, zijn hydrofoob. Bovendien is deze holte niet heel specifiek: allerlei verschillende hydrofobe moleculen nestelen zich hier graag.” Dat is een gunstig uitgangspunt als je iets wilt ontwerpen dat je voor verschillende stoffen en reacties wilt gebruiken.
De volgende stap was het vinden van een geschikte katalysator die in het eiwit in te bouwen is. Het moet dus niet te groot zijn en kunnen werken in een biologische omgeving. De groep koos voor aniline, een klein organisch molecuul waarvan bekend is dat het katalytische activiteit vertoont. “Dat hebben we gekoppeld aan een bestaand aminozuur, waardoor een niet-natuurlijk aminozuur ontstond, genaamd p-aminofenylalanine. Dit hebben we ingebouwd in het LmrR-eiwit op een zodanige manier dat de melkzuurbacterie nu zelf dit aangepaste eiwit kan maken. Daarvoor gebruikten we technieken die andere onderzoekers hebben ontwikkeld.” Vervolgens konden ze het nieuwe kunstmatige enzym – het LmrR-eiwit met daarin het niet-natuurlijke aminozuur – uit de bacterie isoleren en gebruiken in verschillende chemische reacties.
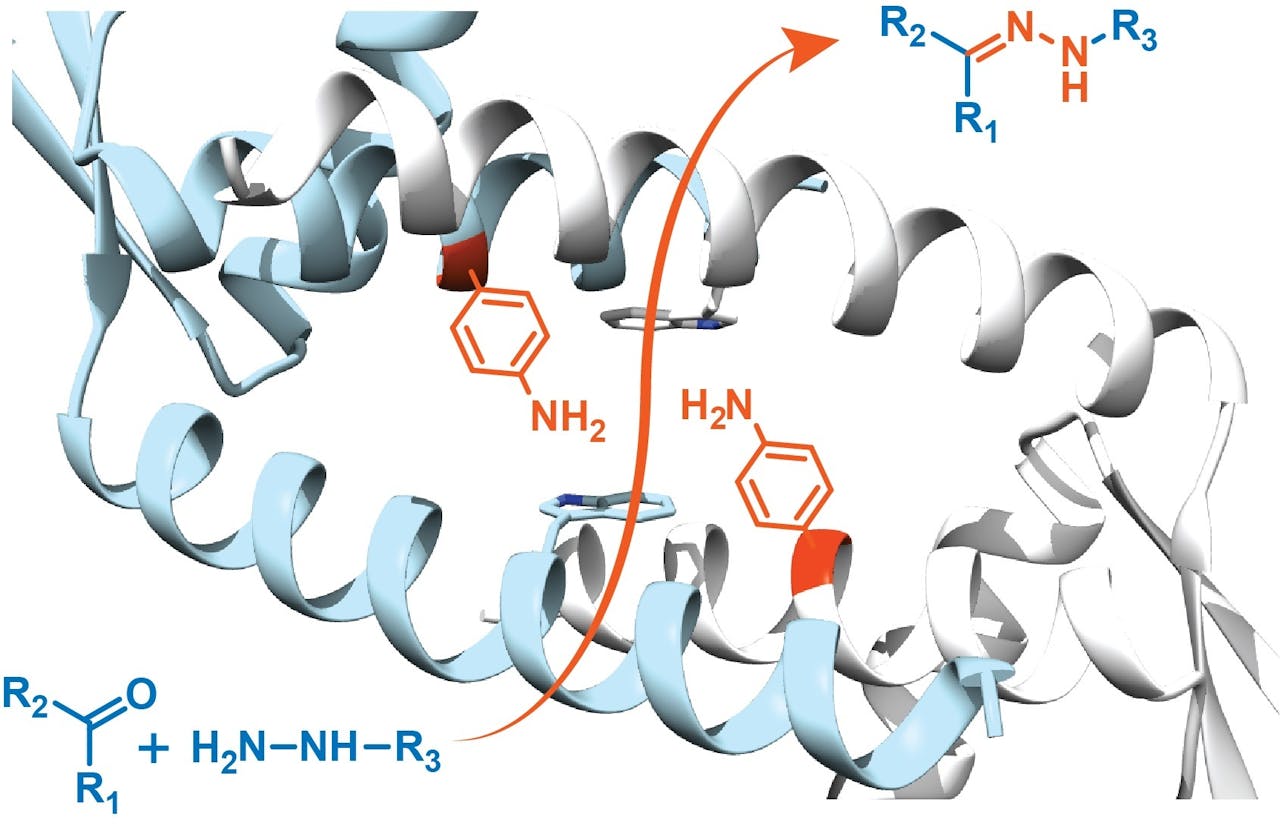
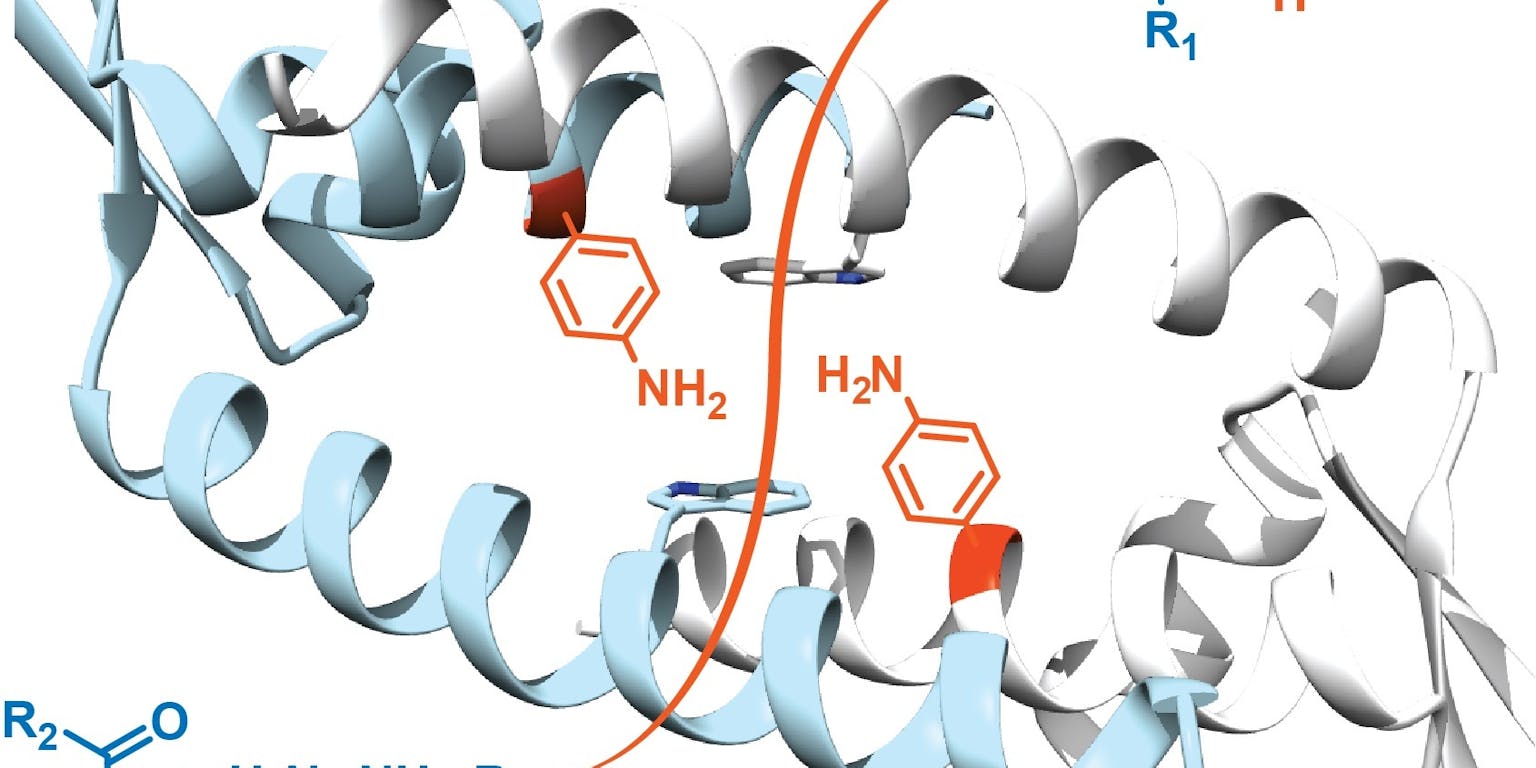
Schematische weergave van de structuur van de holte in het LmrR-eiwit waar Roelfes en zijn team een niet-natuurlijk aminozuur (rood) inbouwden. De combinatie van de specifieke omstandigheden in de holte en de katalytische activiteit van het ingebrachte nieuwe aminozuur zorgen ervoor dat de reactie tussen de twee blauwe moleculen linksonder tot het product rechtsboven, drie ordegroottes sneller verloopt.
Clemens Mayer, RuG via EurekAlert.orgHoogste versnelling
“Dat zijn modelreacties, bedoeld om te testen of het nieuwe enzym echt werkt”, zegt Roelfes. En dat bleek overduidelijk het geval. “We zagen dat de reacties meteen al 600 keer sneller verliepen dan zonder het kunstmatige enzym. Inmiddels zijn we al weer verder met het optimaliseren en is het gelukt om de versnelling naar 16.000 keer op te schroeven en ik verwacht dat hier nog veel meer winst te behalen is.” Door de reacties ook uit te voeren met alleen het niet-aangepaste LmrR-eiwit en met alleen het niet-natuurlijke aminozuur kon de groep aantonen dat het katalytische effect echt in de combinatie van beide zit. Zowel de hydrofobe holte als het niet-natuurlijke aminozuur spelen een essentiële rol. “Samen kun je daarom echt spreken van een nieuw enzym”, concludeert Roelfes.
En nu? Gaan ze dit nieuwe enzym verder verbeteren of nog andere varianten maken? “Dat gaan we natuurlijk doen, maar niet zozeer om steeds nieuwe enzymen te maken. Wat wij willen is een set algemeen geldende ontwerpregels voor enzymen opstellen. Uit dit type experimenten wil ik leren wat de belangrijkste regels zijn, zodat we in de toekomst op een rationele manier te werk kunnen gaan. Nu is het vooral nog veel proberen, wel op basis van goede argumenten, en dan maar zien waar het toe leidt. Ik wil graag naar een aanpak waarin je vooraf weet aan welke kenmerken je enzym moet voldoen als je een bepaalde reactie wilt uitvoeren.”