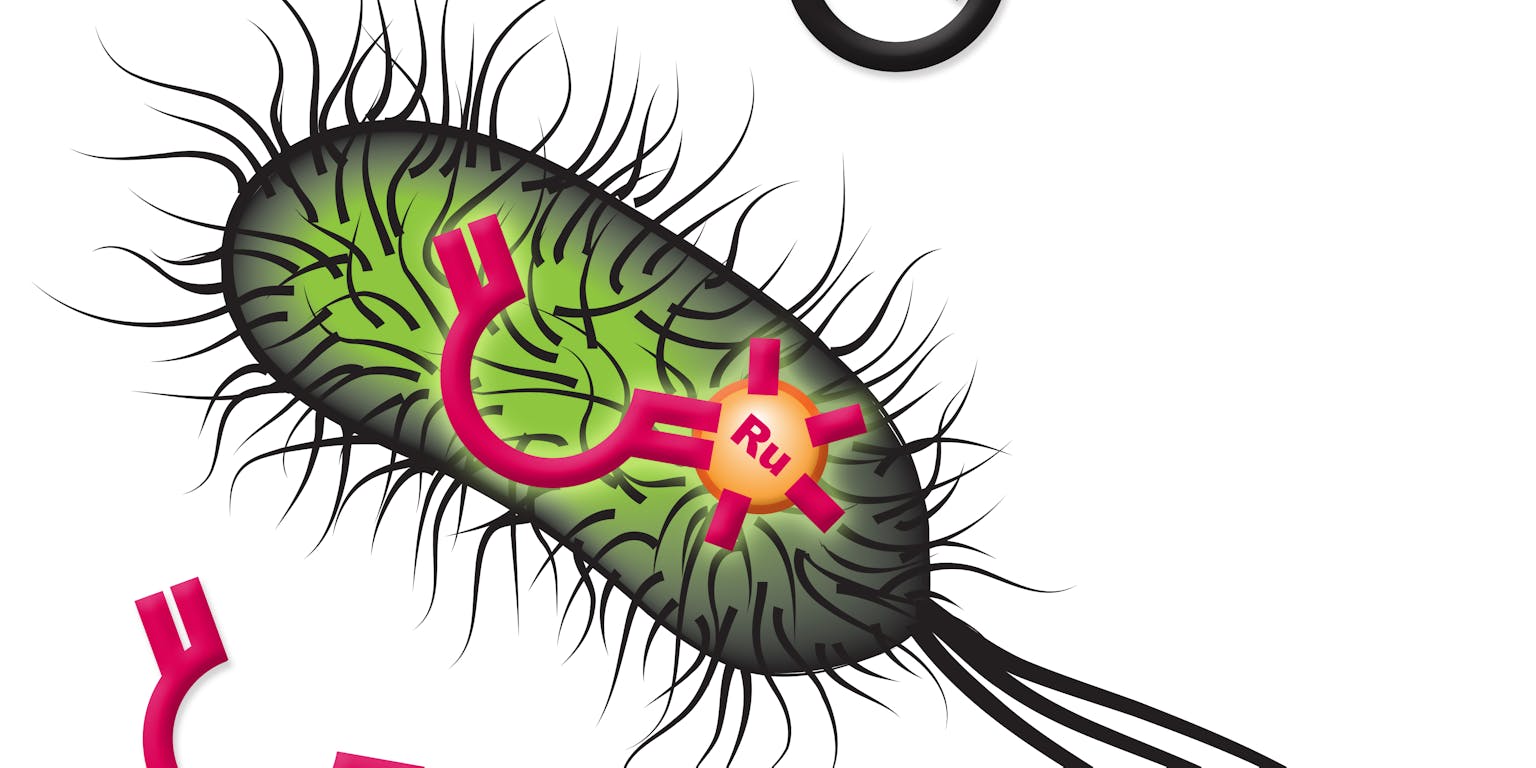
Voor het eerst is het gelukt een kunstmatig enzym in een levende cel een niet-natuurlijke reactie te laten uitvoeren. Dat biedt nieuwe mogelijkheden om ingewikkelde moleculen veel efficiënter te produceren, bijvoorbeeld voor werkzame stoffen in geneesmiddelen. Zwitserse chemici ontwierpen het nieuwe enzym waarmee de bacterie E. coli zonder problemen aan de slag kan.
Bacteriën, gisten, schimmels, maar ook onze eigen lichaamscellen maken aan de lopende band grote, ingewikkelde moleculen. Dat doen ze zo goed dat chemici er jaloers naar kijken. Het geheim schuilt in de enzymen, de katalysatoren van de natuur. Dankzij enzymen kunnen levende cellen heel efficiënt de meest complexe stoffen maken. Zonder dat ze de extreme omstandigheden van een laboratorium (hoge temperatuur, ongezonde chemicaliën) nodig hebben.
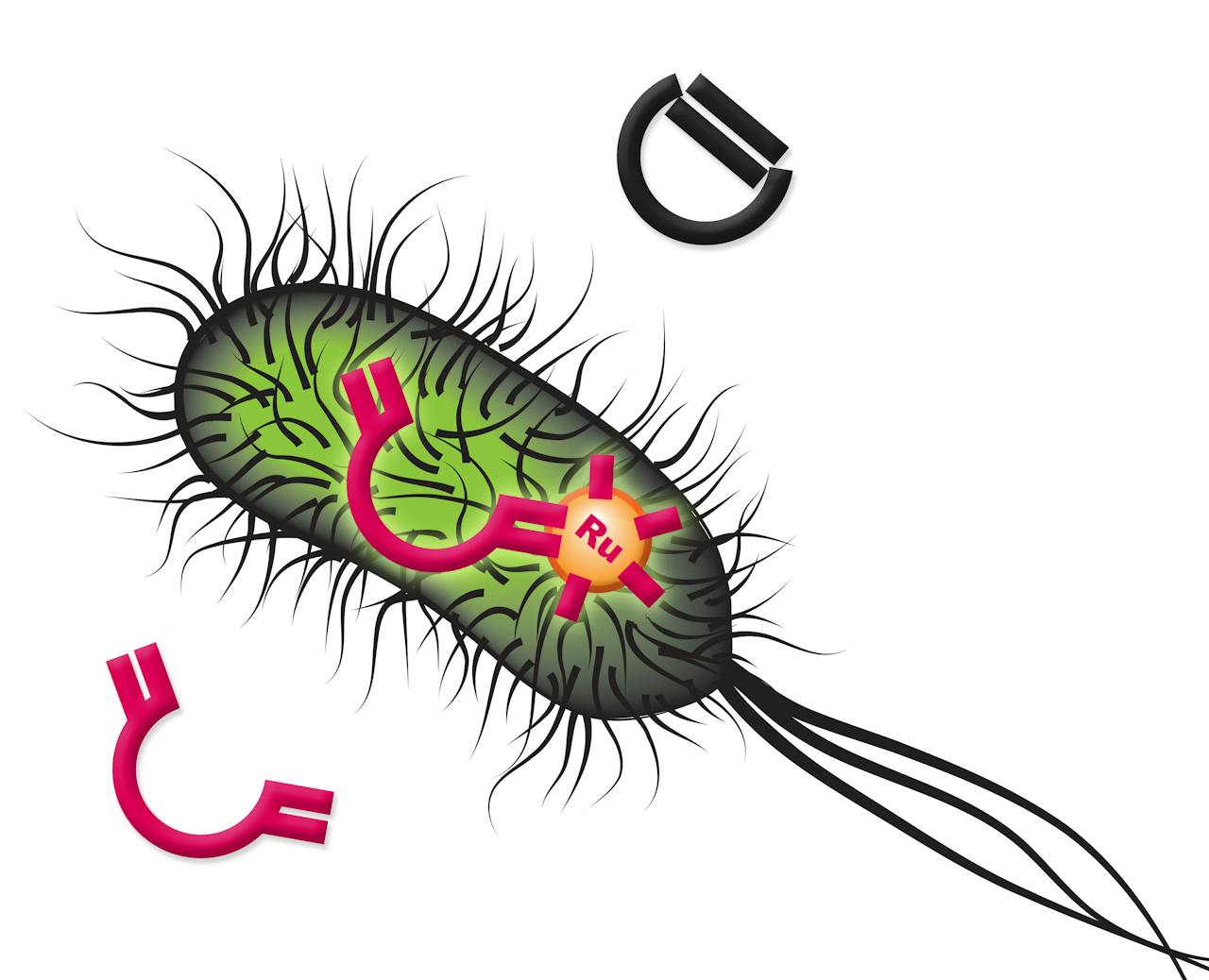
Dus proberen chemici nieuwe enzymen te ontwerpen die de gewenste reacties uitvoeren in een levende cel. Een Zwitsers team is dat nu voor het eerst gelukt. Dankzij hun kunstmatige enzym voert de bacterie E. coli een chemische reactie uit die in de natuur niet voorkomt. Ze publiceerden hun werk afgelopen week in Nature. Gerard Roelfes, hoogleraar Biomoleculaire Chemie & Katalyse aan de Rijksuniversiteit Groningen, werkt zelf ook aan kunstmatige enzymen, maar was niet betrokken bij dit onderzoek. Hij reageert enthousiast op het verzoek van NEMO Kennislink om de publicatie te becommentariëren. “Het is heel mooi werk. Het was een van dé grote uitdagingen in dit veld om een levende cel een niet-natuurlijke reactie te laten uitvoeren met behulp van een artificieel enzym. Dat is hen nu voor het eerst gelukt. Een geweldig resultaat, nu weten we dat het kan.”
Beste van twee werelden
De natuur beschikt over een ongelooflijk grote hoeveelheid verschillende enzymen. Waarom is het de moeite waard ook nog kunstmatige enzymen te maken? Omdat je dan het beste van twee werelden kunt combineren, aldus Roelfes. “De natuur is heel erg goed in het efficiënt maken van ingewikkelde moleculen. Daar kunnen chemici niet aan tippen. Maar het repertoire aan chemische reactiemogelijkheden in de natuur is beperkt. Dus zodra je iets wilt veranderen aan een molecuul of je wilt een molecuul maken dat in de natuur niet voorkomt, dan loop je met biosynthese snel vast.”
Hier komt de kracht van de chemie op de hoek. Scheikundigen zijn juist heel goed in het gericht veranderen van een molecuul en het ontwerpen van nieuwe moleculen met gewenste eigenschappen. “Wij hebben een enorm arsenaal aan chemische mogelijkheden tot onze beschikking. Door kunstmatige enzymen te ontwerpen combineren we de synthetische kracht van de natuur met het brede aanbod aan reacties van de chemie, zodat we heel efficiënt precies die moleculen kunnen maken die we willen.” Denk bijvoorbeeld aan de werkzame stoffen in geneesmiddelen. Vaak zijn dat ingewikkelde moleculen die in de natuur niet voorkomen, maar die in het lab moeilijk te maken zijn. Of het zijn stoffen die heel sterk lijken op natuurlijke moleculen, maar net een kleine aanpassing nodig hebben. Ook dan kan een kunstmatig enzym uitkomst bieden.
Relevante reactie
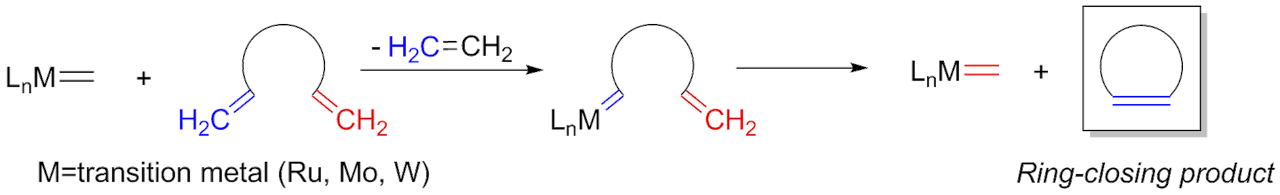
De Zwitsers combineerden voor hun nieuwe enzym het natuurlijke eiwit streptavidine met biotine (vitamine B8). Van deze combinatie is bekend dat ze heel sterk aan elkaar ‘plakken’. Aan het biotine koppelden ze nog een extra chemische groep die het metaal ruthenium (Ru) bevat. Dat is een bekende katalysator om alkenen te maken. Alkenen zijn moleculen die een dubbele koolstofbinding hebben. Een goede keus, vindt Roelfes. “Ze laten het nieuwe enzym een zogeheten metathese reactie uitvoeren en dat is een van de meest gebruikte manieren om een alkeen te maken. Dit is voor chemici een heel relevante toepassing.”
Kunnen we op termijn kunstmatige enzymen in de industrie verwachten? Roelfes denkt van wel. “We maken nu al heel veel verschillende producten via fermentatie door micro-organismen zoals bacteriën, gisten of schimmels in te zetten als productiefaciliteit. Bijvoorbeeld voor vitaminen, maar ook voor allerlei niet-natuurlijke stoffen die we gebruiken in geneesmiddelen. Met kunstmatige enzymen kunnen we micro-organismen nog veel meer complexe moleculen laten maken. Op een veel efficiëntere manier dan nu in het lab. Daar zie ik echt realistische toepassingen.” Een stap naar de productie van eenvoudige chemicaliën lijkt hem niet waarschijnlijk. “Dit is geen alternatief voor de bulkchemie, zoals de productie van etheen of andere simpele bouwstenen voor kunststoffen. Die volumes haal je niet met fermentatie.”
De kunstmatige enzymen die Roelfes maakt zijn gebaseerd op een ander systeem en hij zal met de resultaten uit deze publicatie niet meteen in het lab aan de slag gaan. “Maar je leert altijd van andere groepen en er zitten voor ons zeker interessante lessen in. Voor mij zit de waarde van dit werk in het aantonen van het principe. Dat het überhaupt mogelijk is om in een levende cel op deze manier een niet-natuurlijke reactie uit te voeren. Dat was echt nog geen uitgemaakte zaak hoor, dat dat zou lukken.”