Krijgen we in de toekomst echt designerbaby’s? Baby’s waarvan het DNA is aangepast, zodat ze geen nare ziektes zullen krijgen en waardoor ze bovendien erg knap, intelligent en sportief zullen zijn? Of loopt het niet zo’n vaart…?
Sinds wetenschappers aan het begin van deze eeuw een technologie ontdekten om in het DNA van levende cellen te kunnen knippen, zijn ze volop aan het experimenteren geslagen. Met CRISPR-Cas kunnen wetenschappers niet alleen het DNA van bacteriën of plantencellen aanpassen, maar ook van dieren en mensen. Vooral het bewerken van het DNA van menselijke embryo’s, is een punt van discussie.
Wetenschappers en media speculeren veel over de mogelijkheden. De techniek zou het mogelijk maken om ziekteverwekkende genen uit het DNA van jonge embryo’s te halen, of deze genen te vervangen door ‘gezonde’ genen. Daarnaast zou de techniek het mogelijk maken om ‘designerbaby’s’ te creëren: baby’s die (naar de smaak van hun ouders) een bepaalde oog- of haarkleur krijgen, extra spiergroei ontwikkelen, of een verhoogde kans hebben om intelligenter te zijn. Maar wat kan er nu echt met deze techniek? En wat – hoogstwaarschijnlijk – nooit?
Disclaimer
Omdat CRISPR-Cas een nieuwe techniek is, is er nog relatief weinig naar onderzoek gedaan, zeker op het vlak van menselijk embryo-DNA. Er is dus weinig bekend over de risico’s die aan de techniek kleven. Veel van de voorbeelden in dit artikel gelden daarom ‘in theorie’: ze zijn nog niet getest op menselijke embryo’s, laat staan op embryo’s die geplaatst zijn in een baarmoeder en zo konden volgroeien tot mensen. We weten ook nog niet wat de langetermijngevolgen zijn van ingrepen in het DNA.
Het maken van designerbaby’s met behulp van CRISPR-Cas lijkt zo makkelijk, maar is het niet.
Panuwach/Shutterstock.comWat kan er?
Een toepassing van CRISPR-Cas die in theorie haalbaar lijkt, is het voorkomen van erfelijke ziektes die terug te leiden zijn tot een foutje op één gen. Bekende voorbeelden van die ‘monogenetische ziektes’ zijn taaislijmziekte, sikkelcelanemie en de ziekte van Huntington. Daarnaast zijn er nog duizenden andere erfelijke ziektes die slechts door een genmutatie worden veroorzaakt. Maar bij lang nog niet alle ziektes is de link tussen ziektebeeld en het gen gelegd.
Er kan op drie manieren iets ‘mis’ zijn bij monogenetische ziektes. Sommige genen bevatten een zogenaamde puntmutatie, een klein foutje in een gen. Het DNA bestaat uit twee strengen, met daartussen bouwsteentjes (nucleotiden) die bestaan uit de stoffen A, T, G, of C. Bij sommige families wijkt er één bouwsteentje af, en dat kan een ziekte veroorzaken. Voorbeelden daarvan zijn sikkelcelanemie, de ziekte van Tay-Sachs en taaislijmziekte. CRISPR-Cas zou een verkeerde bouwsteen in het DNA kunnen verwisselen voor een juiste bouwsteen.
Een andere manier waarop er iets mis kan zijn is als een stukje DNA zich te vaak herhaalt in een gen, met als gevolg dat een gen een verkeerd eiwit aanmaakt. Mensen met de ziekte van Huntington hebben een dergelijke afwijking op het gen dat huntingtine-eiwit aanmaakt. Bij hen krijgt het eiwit een abnormaal lange keten van aminozuren, met als gevolg dat het afwijkende huntingtine-eiwit zich ophoopt in de hersens en daar de zenuwcellen beschadigt, zelfs zodanig dat ze afsterven. CRISPR-Cas zou in dit geval het stukje DNA met de ongewenste herhaling uit het gen kunnen knippen.
Een derde manier waarop er iets mis kan zijn met een gen, is wanneer er een stukje DNA ontbreekt. Hierdoor kan het gen een verkeerd eiwit, of zelfs geen eiwit, produceren. Spierdystrofie is hiervan een voorbeeld. Deze ziekte komt vaak bij jongens voor. Door het missende stuk DNA mist het eiwit dystrofine, dat zorgt voor de stevigheid en kracht van spieren. CRISPR-Cas zou bij dit soort aandoeningen het afwezige stuk DNA kunnen invoegen.
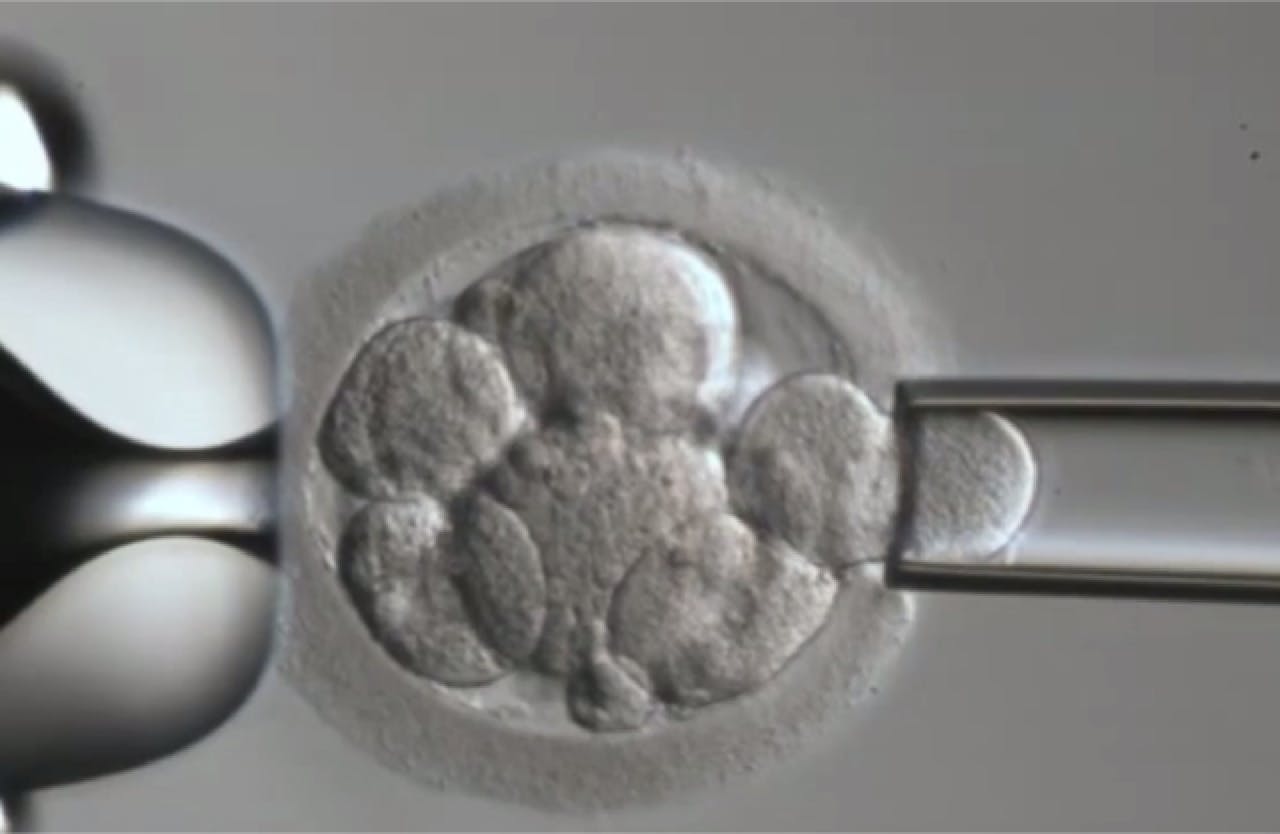
Uit een achtcellig embryo kan één cel worden weggenomen voor genetische diagnostiek.
iStockphotoWat kan er mogelijk nog meer?
Naast het veranderen van monogenetische ziektes, speelt ook het idee om embryo’s eigenschappen te geven die de ouders niet van nature in hun DNA hebben, maar die wel wenselijk kunnen zijn voor het kind. Dat zou mogelijk zijn door stukjes DNA in genen te corrigeren of toe te voegen.
De Chinese biofysicus Jiankui He heeft dit in 2018 gedaan bij de tweeling Lulu en Nana. Hij wist dat tien procent van de Europeanen een mutatie heeft in gen CCR5 waardoor ze resistent zijn tegen hiv-besmetting. Omdat de vader van de tweeling hiv had, wilde hij deze twee meisjes ook resistent maken. Hij behandelde daarom de twee embryo’s met de CRISPR-Cas-technologie en hoopte daarmee de bekende mutatie na te maken. Of dat gelukt is, is niet precies bekend. Jiankui He heeft nooit wetenschappelijk gepubliceerd over zijn werkwijze.
Andere voorbeelden van genen waaraan zou kunnen worden gesleuteld zijn het ApoE-gen, een gen dat een groot effect heeft op de ontwikkeling van alzheimer. Of het gen dat erytropoëtine-hormoon (oftewel epo) aanmaakt, waardoor een kind extra veel uithoudingsvermogen krijgt en wat handig kan zijn bij het sporten.
Wat kan er nooit?
Naast de uitzonderlijke ziektes die tot één gen terug te voeren zijn, zijn er bij de meeste ziektes en menselijke eigenschappen honderden tot duizenden genen betrokken. Dat heet polygenie. Dit maakt het lastig, zo niet onmogelijk, CRISPR-Cas te gebruiken om deze eigenschappen van een embryo aan te passen.
“Ik ken geen enkele psychische eigenschap van mensen waarbij er maar één genmutatie te vinden is”, zegt Tinca Polderman. Zij is biologisch psycholoog aan de VU in Amsterdam en publiceerde onlangs een overzichtsstudie van tien jaar onderzoek naar de genen die betrokken zijn bij complexe menselijke eigenschappen. Daarin concludeert ze dat bij de meeste menselijke ziektes of eigenschappen honderden tot duizenden genen betrokken zijn. “Er is dus niet één gen voor intelligentie”, gaat ze verder. “Er spelen heel veel genen een rol. Elk gen heeft een piepklein effectje en zal misschien voor één procent intelligenter gedrag verklaren.”
Daarnaast oefenen de meeste genen invloed uit op meerdere menselijke eigenschappen. “Genen die bijvoorbeeld een rol spelen bij intelligentie, spelen ook een rol bij autisme”, zegt Polderman. “Je kunt dus aan een gen van intelligentie sleutelen, maar je weet dan het effect op autisme niet.”
Veel menselijke eigenschappen zijn dus simpelweg te complex om aan te passen. Polderman: “Er zijn meer dan duizend genen bekend die met intelligentie te maken hebben. Ga maar eens onderzoeken welk gen wat doet. Dat zou je eerst moeten onderzoeken in dierstudies, en dan heb je per gen minstens één dierstudie nodig.”
Maar genen zeggen niet alles
Slechts een deel van lichamelijke aandoeningen, de uiterlijke kenmerken of het karakter van een mens is terug te voeren op DNA. De rest is een kwestie van de levensstijl. Een kind kan door de extra epo in zijn bloed wel een sterk uithoudingsvermogen hebben, maar zal zijn sportiviteit nooit ontwikkelen als het sport niet zo interessant vindt, of wanneer de ouders het sporten niet stimuleren. “Misschien werkt extra epo wel, maar het kind moet zelf ook nog willen sporten”, zegt geneticus Iris Jonkers van de Universiteit Groningen.
Dat niet elk gen tot volledige expressie komt, komt doordat er op het DNA nog een laag aan informatie zit die de genen aanstuurt. De zogenaamde ‘epigenetica’. Die informatie bepaalt welke genen ‘aan of uit’ staan, en dus welke ziektes of eigenschappen tot uiting komen. Omgevingsfactoren zoals voeding, leefstijl en opleiding beïnvloeden de epigenetica.
“Als een soort controlebord regelt de epigenetica of je bepaalde ziektes of eigenschappen wel of niet krijgt”, vertelt Jonkers. Dat betekent dat je dus wel genetische aanleg kunt hebben voor sproeten, een gedrongen lichaamsbouw of hoge intelligentie, maar omgevingsfactoren kunnen ervoor zorgen dat de uitkomst toch anders is. Haarkleur is een van de weinige eigenschappen waarbij omgevingsfactoren bijna niet van invloed zijn.
De eigenschappen van een mens worden dus geprogrammeerd door de leefomgeving en honderden genen. Wanneer we designerbaby’s willen maken, zouden onderzoekers dus zowel het DNA als de epigenetica op enorm veel plekken aan moeten passen. Dat maakt het extreem complex en waarschijnlijk onhaalbaar. Jonkers: “Hoe we die epigenetica kunnen aanpassen weten we nog niet. De werking daarvan is voor ons nog een black box.”
Dus ook al zal de CRISPR-Cas-technologie zich de komende jaren verder ontwikkelen en neemt de kennis over de menselijke genen toe, het bewerken van embryo-DNA blijft enorm complex en risicovol. Het is dus de vraag of CRISPR-Cas ooit ingezet zal worden om designerbaby’s te maken.