Je zit in een druk café en kijkt een beetje rond. Dan valt je blik op een ontzettend lekker stuk. Hij kijkt ook in jouw richting, er is oogcontact en een vonk springt over. Je wilt naar hem toe, zo snel mogelijk, maar de andere gasten blokkeren je pad. Nu weet je hoe een gemiddeld molecuul in je cellen zich voelt.
Er is nogal wat chemie tussen de moleculen in een cel, ze willen graag met elkaar in contact komen. Biochemici bestuderen de reacties tussen moleculen in hun reageerbuizen, maar de condities bij zo’n laboratoriumexperiment verschillen doorgaans nogal van die in een echte cel. “Een cel zit boordevol moleculen”, legt RUG-hoogleraar biochemie Bert Poolman uit. En net als die twee mensen in het drukke café kunnen de moleculen zich daarom niet zo vrij bewegen. “De diffusiesnelheid in cellen is doorgaans veel lager dan in een reageerbuis.”
Gebrek aan informatie
Een reden waarom biochemici hun experimenten niet doen in een realistisch milieu is een gebrek aan informatie over de ‘drukte’ in cellen. “Die moet je schatten op basis van het gemiddelde volume van cellen en de gemiddelde concentratie van stoffen”, legt Poolman uit. Zulke schattingen zijn niet heel nauwkeurig. “Denk maar aan de bezoekers van een popconcert: bij het podium staan die zo dicht opeen gepakt dat ze zich bijna niet kunnen bewegen. Maar verder naar achteren is er veel meer ruimte.”
Biologen gaan er vanuit dat ook binnen cellen de concentratie moleculen in verschillende compartimenten niet gelijk is. Alleen konden ze dat niet direct meten. Maar daar is nu verandering in gekomen: dr. Arnold Boersma uit de groep van Poolman heeft een moleculaire sensor ontwikkeld die de drukte nauwkeurig kan meten. Een beschrijving is op 2 februari gepubliceerd in het tijdschrift Nature Methods.
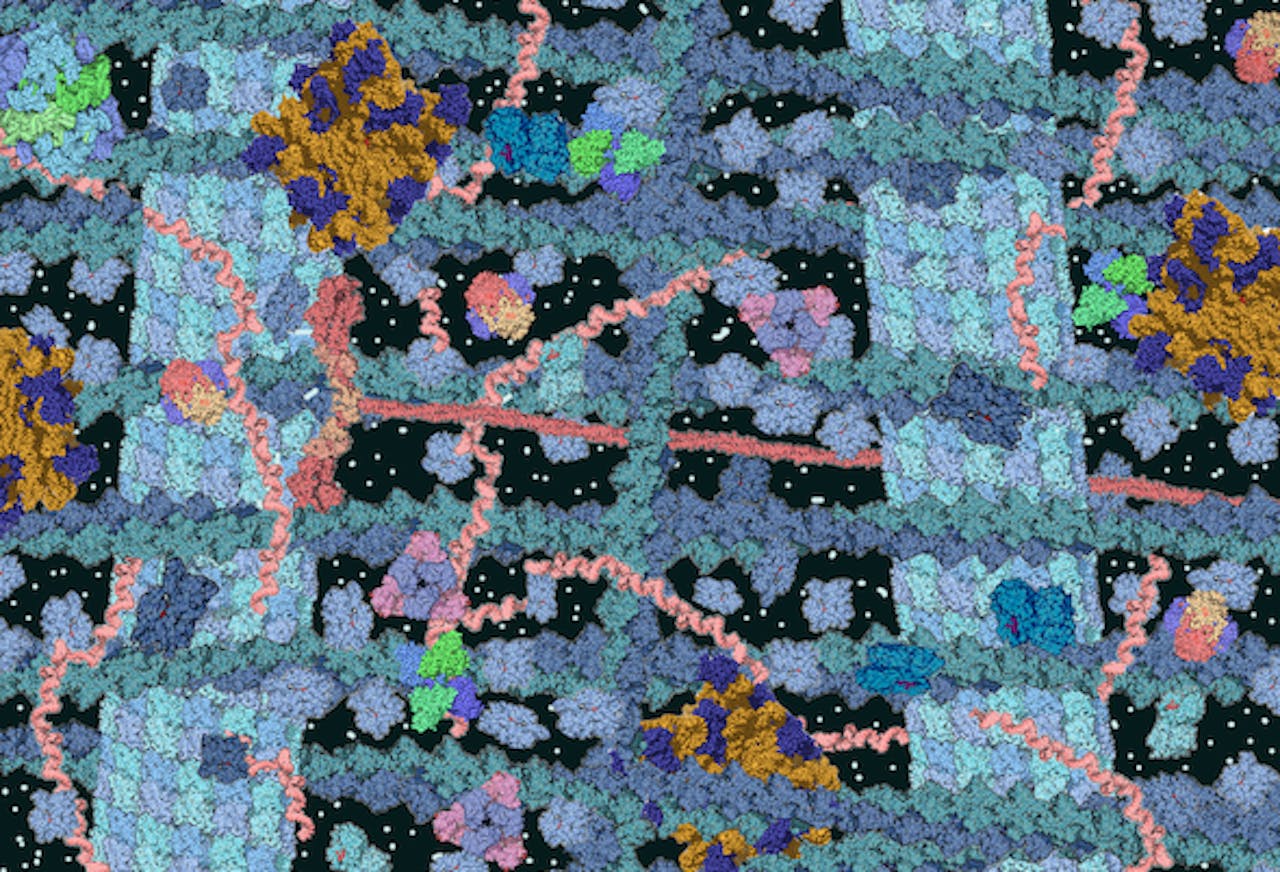
Drukte! De biologische cel zit bomvol met moleculen die een ingewikkelde wisselwerking met elkaar aangaan.
TimVickers via publiek domeinSamengedrukte veer
Boersma en Poolman ontwierpen een ‘veer’ van eiwit die samengedrukt wordt in een drukke omgeving. Denk even terug aan dat drukke café, en je poging om bij die knappe knul te komen. Waar het heel druk is zitten je armen stijf tegen je lichaam aan, je maakt jezelf zo smal mogelijk. Waar meer ruimte is kunnen je armen wat meer uitsteken.
De truc is dat de RUG-onderzoekers zichtbaar wisten te maken in welke mate de veer is samengedrukt. Dit deden ze door fluorescerende eiwitgroepen te plaatsen op beide uiteinden, de ‘armen’ van met molecuul. De eerste eiwitgroep zendt blauw licht uit wanneer hij door een laser wordt beschenen. Het blauwe licht slaat de tweede eiwitgroep aan die vervolgens geel licht gaat uitzenden. De overdracht van energie is recht evenredig met de afstand tussen beide groepen. Deze techniek heet ‘Förster resonance energy transfer’ (FRET).
De hoeveelheid geel licht die het molecuul uitzendt is een maat voor de afstand tussen beide eiwitgroepen en die afstand wordt bepaald door de moleculaire drukte (de technische term is ‘crowding’) in de cel. In het artikel laten de onderzoekers zien dat op deze manier de hoeveelheid moleculen in het cytosol (het celvocht) op een betrouwbare manier is te meten.
Kunstmatig gen
Er is een kunstmatig gen gemaakt dat zorgt voor de aanmaak van de sensor in cellen. Daar zijn twee versies van, een voor bacteriële cellen en een voor zoogdiercellen. “Wij zullen de sensor gebruiken om de structuur van het cytoplasma tijdens de celcyclus in kaart te brengen”, zegt Poolman. “Onze interesse gaat uit naar de manier waarop cellen hun volume kunnen regelen, iets dat natuurlijk de mate van crowding in de cel beïnvloedt. Maar er zijn nog tal van andere mogelijke toepassingen voor deze sensor.”
Poolman is wetenschappelijk directeur van het Centre for Synthetic Biology aan de Rijksuniversiteit Groningen. De synthetische biologie heeft als doel om cellen te ontwerpen en te bouwen zodat ze bijvoorbeeld geneesmiddelen of andere nuttige verbindingen produceren. Maar je kunt pas een nieuwe cel ontwerpen wanneer je goed weet hoe alles in de cel werkt. “De crowding in de cel heeft invloed op tal van processen, zoals de snelheid waarmee verbindingen reageren, de aantrekkingskracht tussen biomoleculen, de snelheid waarmee eiwitten zich vouwen en de stabiliteit van de eiwitstructuur.”