Een levende cel beschikt over ‘kanalen’ om stoffen van binnen naar buiten te transporteren en andersom. Die kanalen zijn eiwitten in de celmembraan die zich kunnen openen en sluiten. De meeste kanalen laten slecht één type stof door, maar een bepaalde familie van eiwitkanalen is in staat om zowel vetten als zouten door te laten. Groningse onderzoekers hebben nu ontdekt hoe die eiwitten dat klaarspelen.
In de jaren 1980 ontdekten wetenschappers chloride kanaaltjes in cellen, die werden geactiveerd door calcium. Deze chloride kanaaltjes zijn eiwitten die chloride ionen (negatief geladen chlooratomen, zoals in keukenzout) kunnen doorlaten. Pas in 2008 werd de ‘identiteit’ van deze eiwitten opgehelderd: ze blijken te horen bij de zogeheten TMEM16 familie. Dit is een groep verwante membraaneiwitten die betrokken zijn bij verschillende belangrijke transportprocessen. “De chloridekanaaltjes leken bruikbaar bij de behandeling van taaislijmziekte, waarbij het chloridetransport in de longen en andere organen niet goed werkt”, vertelt Cristina Paulino, assistant professor en hoofd van de cryo-EM afdeling van de Rijksuniversiteit Groningen.
TMEM16 eiwitten zijn evolutionair gezien heel oud, ze zijn ook aanwezig in eencelligen en verschillende schimmels. In mensen zijn tien verschillende TMEM16 genen, stukjes DNA die de code bevatten voor een eiwit, gevonden. Maar toen onderzoekers ook de functie van die genen bestudeerden, kwam daar iets verrassends uit. Paulino: “Twee van de genen zorgden inderdaad voor de aanmaak van chloridekanaaltjes. Maar de andere codeerden voor zogeheten scramblases, eiwitten die de fosfolipiden, de bouwstenen van de celmembraan, kunnen verplaatsen tussen de twee helften van de dubbele laag die de celmembraan vormt.”
Dodelijke verplaatsing
De celmembraan is niet symmetrisch in samenstelling: de binnenste laag bevat andere fosfolipiden dan de buitenste laag. Scramblases kunnen de lipiden van de ene naar de andere kant te verplaatsen en dat kan grote gevolgen hebben. “Dit levert een sterk signaal op”, legt Paulino uit. “Als er bijvoorbeeld lipiden aan de buitenkant terechtkomen die eigenlijk aan de binnenkant horen, kan dat de cel tot zelfmoord aanzetten of bloedstolling activeren.” Het is daarom van groot belang voor de cellen om de activiteit van deze scramblases zeer nauwkeurig te reguleren. Maar wat het ingewikkeld maakt is dat de scramblase eiwitten zich ook gedragen als niet-selectieve ionen-kanaaltjes. Ze kunnen dus zowel fosfosfolipiden als ionen verplaatsen. De vraag was hoe een eiwit zulke verschillende taken kan uitvoeren.
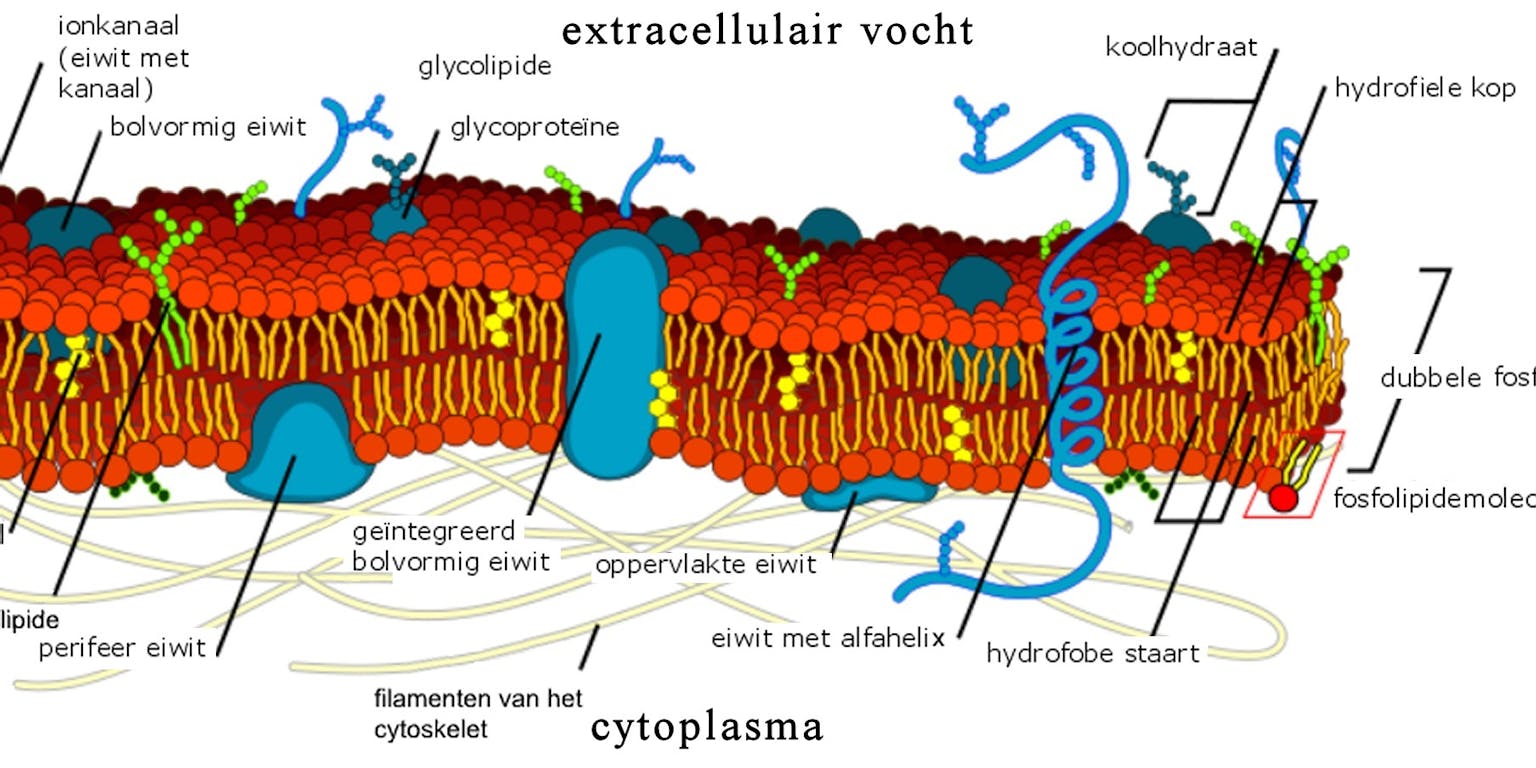
Schematische weergave van een celmembraan met helemaal links een ionkanaal en de dubbele laag fosfolipiden.
LadyofHats via Wikimedia Commons, publiek domeinIn eerder onderzoek wist Paulino met behulp cryo-elektronenmicroscopie de structuur van TMEM16A op te helderen. Dit eiwit functioneert exclusief als een chloridekanaal. Samen met de structuur van het verwante schimmeleiwit nhTMEM16, leverde dit meer begrip op over de manier waarop de TMEM16 familie werkt. “We begonnen te begrijpen hoe eiwitten met een vergelijkbare structuur zich in verschillende taken kunnen specialiseren.” In de structuur van de scramblases zag ze een soort lange gleuf die door de celmembraan heen liep, en waar lipiden doorheen konden schuiven. In de structuur van de chloridekanaaltjes was die gleuf juist afgesloten. Deze eiwitten vormden een porie waardoor ionen zich door de membraan konden verplaatsen.
Open, dicht en een tussenvorm
Maar er bleven nog belangrijke vragen open, bijvoorbeeld over de rol van calcium in de activiteit van deze eiwitten. “We wilden graag weten hoe calcium de activiteit van scramblases kan reguleren en hoe sommige van die eiwitten tegelijkertijd ionentransport kunnen faciliteren.” Om dit uit te zoeken besloot Paulino om het eiwit TMEM16F uit zoogdiercellen te bestuderen. Dit speelt een belangrijke rol bij bloedstolling. Ze wisten de structuur van het eiwit te achterhalen, zowel met als zonder calcium. Dat zou normaal gesproken een duidelijke verschillende open en gesloten staat moeten opleveren. Maar de structuren met en zonder calcium bleken nauwelijks te verschillen. Om verder te komen was er meer informatie nodig en dus ging Paulino terug naar het eerder bestudeerde schimmeleiwit nhTMEM16.
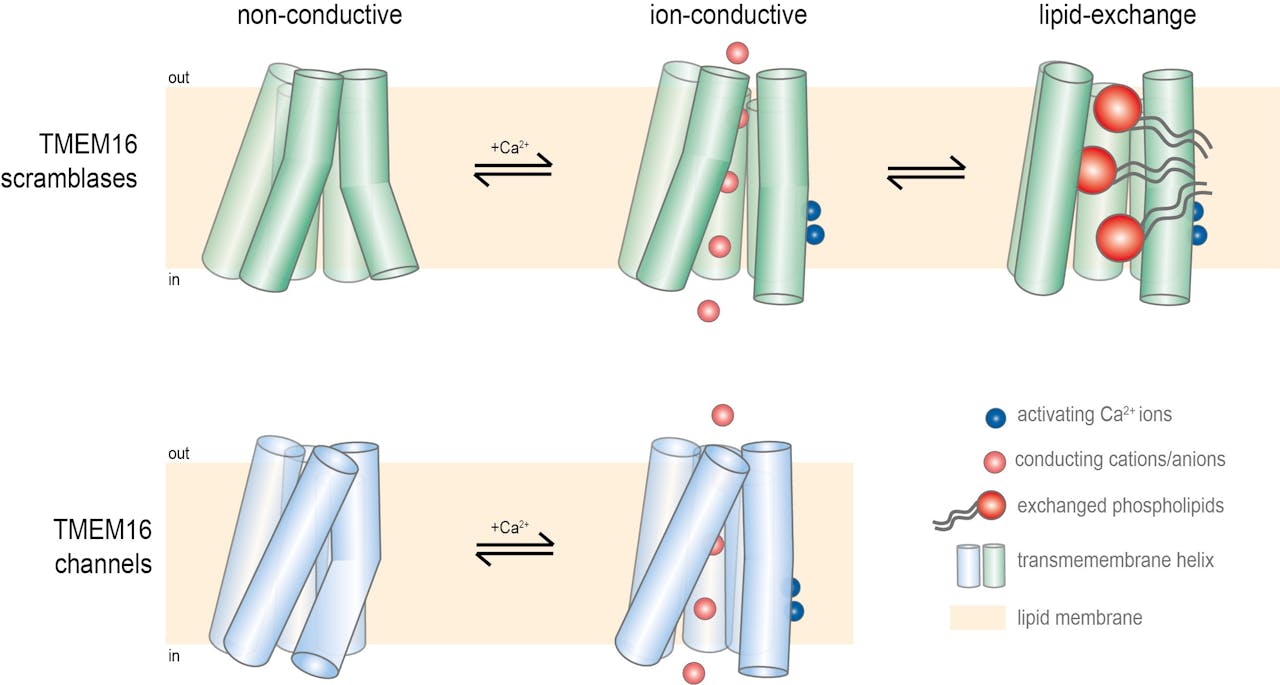
De verschillende toestanden van de scramblases en kanalen. Boven een scramblases in drie toestanden: links de gesloten toestand, in het midden de vorm waarin de kleine ionen erdoor kunnen en rechts de open toestand met een brede gleuf waar ook de grote lipiden doorheen passen. Onder de structuur van een ionen-kanaal met weer links de gesloten en recht de open toestand. In alle gevallen zorgen calcium-ionen (blauw) voor de activering.
Christina Paulino (RUG)De experimenten met dit eiwit leverden meer succes op. Paulino en haar collega’s zagen een open toestand met een groeve die fosfolipiden kon transporteren. Daarnaast waren er een gesloten toestand en een tussenvorm waarin ionentransport mogelijk was. “Hier vonden we dus alle drie de toestanden, en allemaal in de aanwezigheid van calcium dat juist een open toestand zou moeten induceren. Onze resultaten suggereren dat de structuur zeer dynamisch is, waarbij de verschillende toestanden met elkaar in evenwicht zijn.” De resultaten wijzen er ook op dat er naast calcium nog een factor betrokken is bij de regulatie van de activiteit van TMEM16 eiwitten. Dat past bij het idee dat de activiteit in cellen heel strikt is gereguleerd.
Scramblases eerst
Inmiddels hebben Paulino en haar collega’s nu een veel duidelijker beeld van de werking van de TMEM16 eiwitten. “We weten dat die niet zwart/wit is, er bestaan verschillende vormen van het eiwit naast elkaar in een dynamisch evenwicht.” In de volledig open toestand werken de eiwitten als scramblases, in de intermediaire toestand is alleen ionentransport mogelijk. Dit suggereert dat de eiwitten ontstaan zijn als scramblases, maar dat sommige familieleden evolueerden tot pure ionenkanalen, mogelijk door mutaties die het eiwit vooral in de intermediaire toestand lieten bestaan.