De Nobelprijs voor de Scheikunde 2017 is toegekend aan Jacques Dubochet, Joachim Frank en Richard Henderson voor de ontwikkeling van de cryo-elektronenmicroscopie. Deze techniek brengt biomoleculen zeer gedetailleerd in beeld.

Nobelprijswinnaars voor de Scheikunde, Jacques Dubochet, Joachim Frank & Richard Henderson.
Nobel Media 2017De voorspellingen zaten er (weer eens) goed naast. De lithium-ion batterijen die we in alle consumentelektronica vinden en de revolutionaire gen-kniptechniek CRISPR-Cas9 stonden bovenaan veel tiplijstjes, maar moeten wederom een jaartje wachten. De Nobelprijs voor de Scheikunde 2017 gaat naar de cryo-elektronenmicroscopie (cryo-EM).
Het Nobelcomité zet daarmee technologie-ontwikkelaars in het zonnetje: wetenschappers die door hun werk andere wetenschappers in staat stellen om geheel nieuwe paden in te slaan en, mogelijk, grote ontdekkingen te doen. De Zwitser Jacques Dubochet, de Duits-Amerikaanse Joachim Frank en de Brit Richard Henderson hebben volgens het Nobelcomité ieder afzonderlijk een cruciale bijdrage geleverd aan de ontwikkeling van cryo-EM en krijgen daarom elk een derde van de prijs.
Met cryo-EM kun je bepalen hoe biologische moleculen, zoals eiwitten, eruit zien. Dat is belangrijk, omdat de werking van biomoleculen voor een heel groot deel samenhangt met hun ruimtelijke structuur. Om te kunnen bestuderen hoe eiwitten opereren helpt het dus enorm als je ze kunt zien. Maar ondanks dat eiwitten in moleculaire termen ‘groot’ zijn, blijven het natuurlijk extreem kleine deeltjes. “Kijken naar een eiwit is alsof je vanaf de aarde een mens op de maan wilt zien”, aldus Peter Brzezinski, lid van het Nobelcomité, tijdens de uitreiking. Dat laatste kunnen we nog niet, maar dankzij cryo-EM kunnen we nu wel eiwitten in groot detail bekijken.
Zika-virus
Om het belang van cryo-EM te onderstrepen wees Brzezinski op de recente, snelle opheldering van de structuur van het Zika-virus. In slechts enkele maanden was een zeer gedetailleerde structuur beschikbaar, iets dat voorheen jaren gekost zou hebben (als het al was gelukt). Voor het ontwikkelen van een therapie of een vaccin is inzicht in de structuur van een virus cruciaal.
Cryo-EM, waarin cryo staat voor ‘bevriezen’, bouwt voort op de al veel langer bestaande elektronenmicroscoop. Die levert structuurinformatie met hoge resolutie (oplossend of onderscheidend vermogen), maar is ongeschikt voor biologisch materiaal. Een elektronenmicroscoop gebruikt een krachtige bundel elektronen in plaats van licht en biomoleculen overleven dat niet. Het monster brandt dan kapot. Bovendien wordt het monster in een vacuüm geplaatst en ook dat is ongeschikt voor biologisch materiaal, vanwege de grote hoeveelheid water. In een vacuüm verdampt het water, het monster droogt uit en de biomoleculen verliezen hun natuurlijke vorm. De algemene mening was dan ook dat elektronenmicroscopie simpelweg ongeschikt was voor biomoleculen.
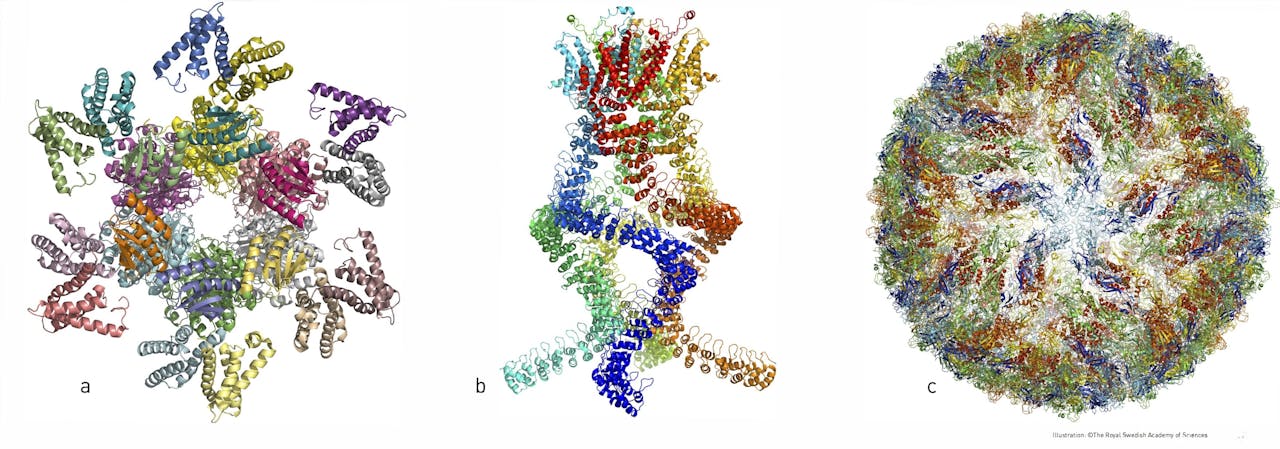
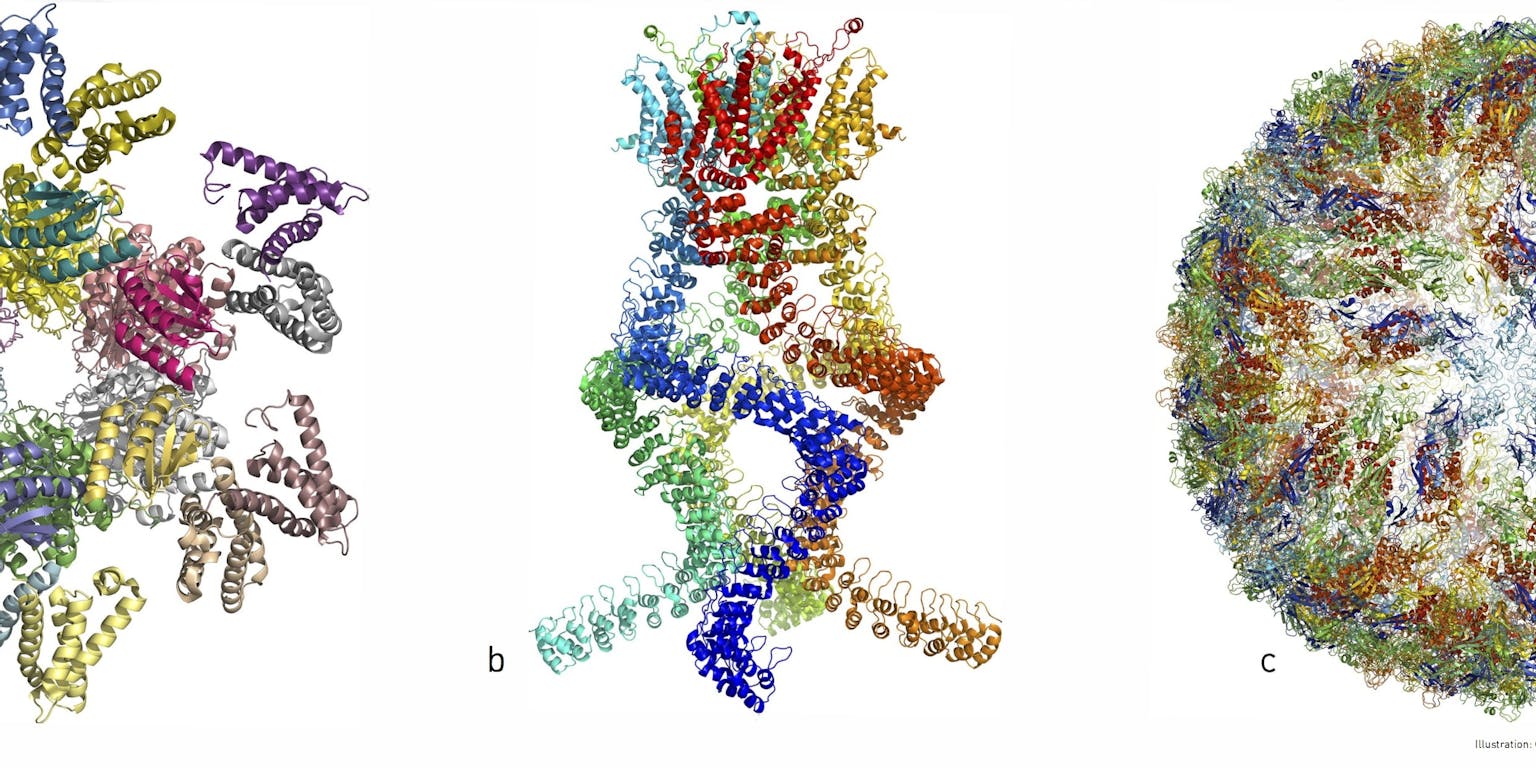
V.l.n.r. het eiwitcomplex uit onze biologische klok; het eiwitcomplex dat drukverschillen waarneemt in ons oor; de eiwitmantel van het Zika-virus. Al deze structuren zijn opgehelderd met behulp van cryo-EM.
Johan Jarnestad/The Royal Swedish Academy of SciencesMembraaneiwitten
Maar die opvatting was aan Richard Henderson (1945) niet besteed. In de jaren zeventig werkte hij aan de Universiteit van Cambridge en daar, net als elders, was eiwitkristallografie dé manier om de structuur van eiwitten te bepalen. Helaas voor Henderson – maar achteraf wellicht een geluk – lieten de membraaneiwitten die hij wilde bestuderen zich niet kristalliseren. Tegen alle heersende wijsheden in besloot Henderson over te stappen naar elektronenmicroscopie om eiwitten in beeld te brengen. Zijn oog viel op bacteriorhodopsine, een paars eiwit dat zich in de membraan bevindt van micro-organismen die licht omzetten in energie (fotosynthese).
Henderson wist dat het niet werkte als je een eiwit uit de membraan haalt, want dan verliest het zijn structuur. Daarom stopte hij het complete membraan in de elektronenmicroscoop met daaromheen nog een suikeroplossing ter bescherming tegen het vacuüm. Door bovendien te spelen met zowel de hoek als de intensiteit van elektronenbundel, bleef het monster intact en werd de structuur zichtbaar. Veel beter zichtbaar zelfs dan algemeen voor mogelijk was gehouden, maar Henderson was verre van tevreden.
In de jaren daarna bleef Henderson stug doorwerken om te bewijzen dat elektronenmicroscopie minstens net zulke gedetailleerde informatie kon leveren als eiwitkristallografie. En met succes: in 1990 publiceerde hij een verbeterde structuur van bacteriorhodopsine met atomaire resolutie.
Patronen in de schaduw
Het succes van Henderson was deels te danken aan de bijzondere en stabiele manier waarop bacteriorhodopsine in een membraan zit gepakt. Dat maakte het bepalen van de structuur relatief makkelijker dan wanneer je kijkt naar een verzameling eiwitmoleculen die allemaal net een andere oriëntatie hebben. Hoe bepaal je de structuur uit een collectie vage stipjes? Rond dezelfde tijd dat Henderson zich vastbeet in de membraaneiwitten, werkte Joachim Frank (1940) in New York aan het probleem van de beeldanalyse. In 1975 stelde hij een theoretische strategie voor die tien jaar later resulteerde in een daadwerkelijke methode.
Frank merkte op dat in de tweedimensionale opnamen van een eiwitmonster extra informatie zat. De willekeurige oriëntatie van alle afzonderlijke eiwitmoleculen zorgde voor een net verschillende ‘schaduw’ in de achtergrond. Frank ontwikkelde een computermethode die patronen in deze schaduwen kan herkennen en de schaduwen kan sorteren. Door afzonderlijke opnames van overeenkomstige schaduwen te combineren ontstaat een veel scherper tweedimensionaal beeld. Eigenlijk een detailopname van iedere ‘kant’ van het molecuul. Vervolgens combineert het programma de afzonderlijke tweedimensionale beelden tot een driedimensionale structuur. Frank demonstreerde de kracht van zijn methode in de jaren tachtig met de publicatie van een model van het ribosoom, het enorme complex dat eiwitten produceert in de cel.
Katapult
Het laatste probleem waar elektronenmicroscopie mee kampte, was het uitdrogen van de kwetsbare biologische moleculen die daardoor hun structuur verloren. De derde laureaat Jacques Dubochet (1942), boog zich over dit probleem. Net als de andere twee vanaf de jaren zeventig, in zijn geval in Lausanne, Zwitserland. Hoe te voorkomen dat het water uit het biologisch monster verdampt? Door het te bevriezen. Dat idee hadden al meer mensen gehad, maar als water bevriest krijg je ijskristallen en die zorgen voor zoveel verstoring van de elektronenbundel dat je helemaal niets meer ziet. Dubochet zag een uitweg: het monster zo snel bevriezen dat er geen tijd is voor kristalvorming en je gestold water krijgt. Net zoals glas ook een gestolde vloeistof is. Door de onregelmatige structuur van het gestolde water raakt de elektronenbundel heel gelijkmatig verstrooid, wat een uniforme achtergrond oplevert waar je geen last van hebt in je beeldanalyse.
Na veel proberen en falen, ontwikkelde Dubochet een eigenlijk zeer eenvoudige techniek. Het monster wordt op een metalen rooster gebracht en vervolgens met een soort katapult heel snel in vloeibaar ethaan van -190 graden Celsius geschoten. In de openingen van het rooster bevindt zich dan een dunne film van gestold (‘gevitrifieerd’) water met daarin de biomoleculen die je wilt bestuderen in hun natuurlijke vorm.
Inmiddels is de cryo-elektronenmicroscopie uitgegroeid tot een vaste waarde in het biomoleculaire structuuronderzoek dat op een routinebasis wordt toegepast om eiwitten, grote eiwitcomplexen en complete virusmantels extreem gedetailleerd zichtbaar te maken. Dankzij het werk van Henderson, Frank en Dubochet kunnen we nu alle onderdelen van een levende cel tot in het kleinste detail zichtbaar maken, aldus het Nobelcomité.