Mobiele telefoons, laptops, elektrische fietsen; je kunt je bijna niet voorstellen wat we allemaal hadden moet missen zonder de uitvinding die dit jaar is bekroond met de Nobelprijs voor de Scheikunde. De Amerikaan John B. Goodenough, de Brit Stanley Whittingham en de Japanner Akira Yoshino ontwikkelden samen de lithium-ion-batterij.
De toekenning van de Nobelprijs aan de vaders van de lithium-ion-batterij komt niet als een verrassing. Zeker de naam van Goodenough stond al jaren bovenaan de voorspellingslijstjes. En dat is ook niet zo gek als je bedenkt wat voor impact het onderzoek heeft gehad op ons dagelijks leven. Zoals het Nobelcomité in het persbericht schrijft: “Deze onderzoekers creëerden een oplaadbare wereld.” Zonder deze batterijen zouden we nog veel meer afhankelijk zijn van stroomdraden en was ook de opslag van bijvoorbeeld duurzame wind- of zonne-energie waarschijnlijk niet echt efficiënt mogelijk geweest.
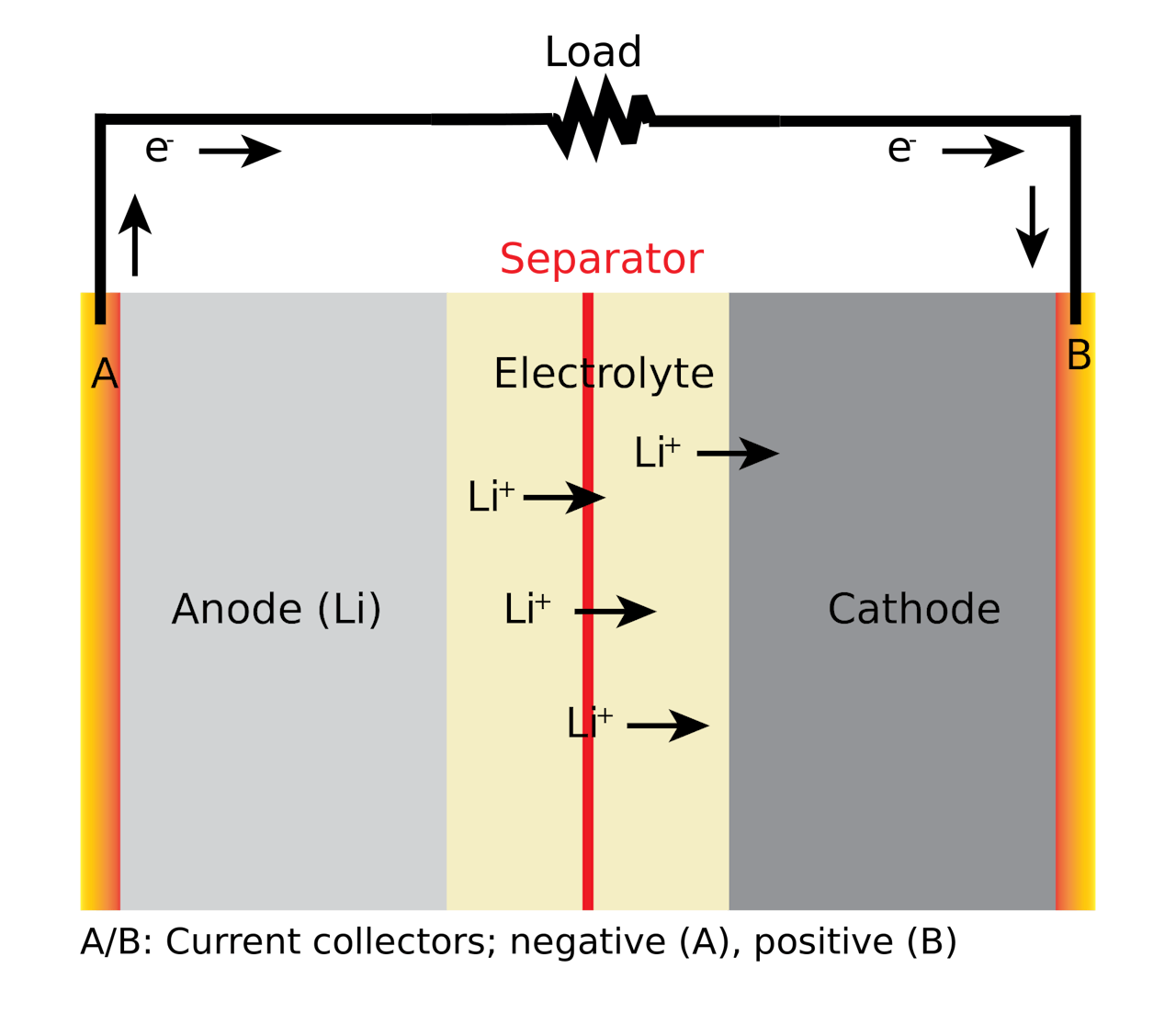
Een lithium-ion-batterij werkt doordat lithiumionen van de anode naar kathode stromen. Bij het opladen stromen de ionen weer terug.
Sdk16420 via CC BY-SA 4.0Energierijk materiaal
De eerste stap naar deze mooie ontdekking werd gedaan door Whittingham. Tijdens de oliecrisis in de jaren zeventig vond hij per toeval een heel energierijk materiaal: titanium disulfide. Dit materiaal is bijzonder omdat het allemaal minuscule gaatjes heeft waar geladen atomen – ionen genoemd – precies in passen. Deze ionen binden vervolgens aan het materiaal en daar komt veel elektrische spanning bij vrij – dit proces heet intercallatie. Die spanning gebruikte Whittingham in een nieuw soort batterij.
Deze nieuwe batterij bestond net als eerdere modellen nog steeds uit twee delen: een anode en een kathode met daartussen een barrière. Het idee is dat de positief geladen ionen van de anode in de richting van de kathode gaan stromen. Op hetzelfde moment willen ook positief geladen elektronen naar die kathode stromen, maar die moeten door een draad. In deze draad ontstaat er dan een elektrische stroom waarmee je bijvoorbeeld een apparaat aan kan drijven. Om het systeem weer op te laden draai je de stroom om, en stromen de ionen weer terug naar de anode.
Steeds meer spanning
Whittingham gebruikte voor zijn kathode het nieuw ontdekte titanium disulfide. Voor de anode koos hij voor lithium, omdat lithium heel reactief is en de positief geladen lithium-ionen graag uit de anode willen ontsnappen. De combinatie bleek goed te werken: de lithium-ionen stroomden graag naar de titanium disulfide waar ze in het materiaal nestelden. Op deze manier wist Whittingham wel twee volt aan spanning op te wekken, en creëerde hij een batterij met veel meer capaciteit dan de tot dan toe bestaande batterijen. De pure lithium bleek alleen niet zo veilig, want na meerdere keren opladen konden er lithiumstaafjes ontstaan die kortsluiting veroorzaakten en de batterij lieten ontploffen.

Stanley Whittingham gebruikte lithium en titanium disulfide om de eerste sterke lithium-ion-batterij te maken. De lithium-ionen stromen van de anode naar de titanium disulfide kathode en wekken zo stroom op.
Johan Jarnestad/The Royal Swedish Academy of SciencesUiteindelijk werden dit probleem opgelost door aluminium aan de lithium anode toe te voegen, maar de batterij was volgens sommige onderzoekers nog niet sterk genoeg. Goodenough ging daarom op zoek naar materialen die ook lithium-ionen konden opnemen, maar hierbij nog meer energie vrijmaken. In 1980 vond hij het lichte materiaal kobaltoxide, dat aan al zijn eisen voldeed. Met deze materialen wist hij een batterij te maken die vier volt aan spanning kon opwekken, en dus nog energiedichter was.
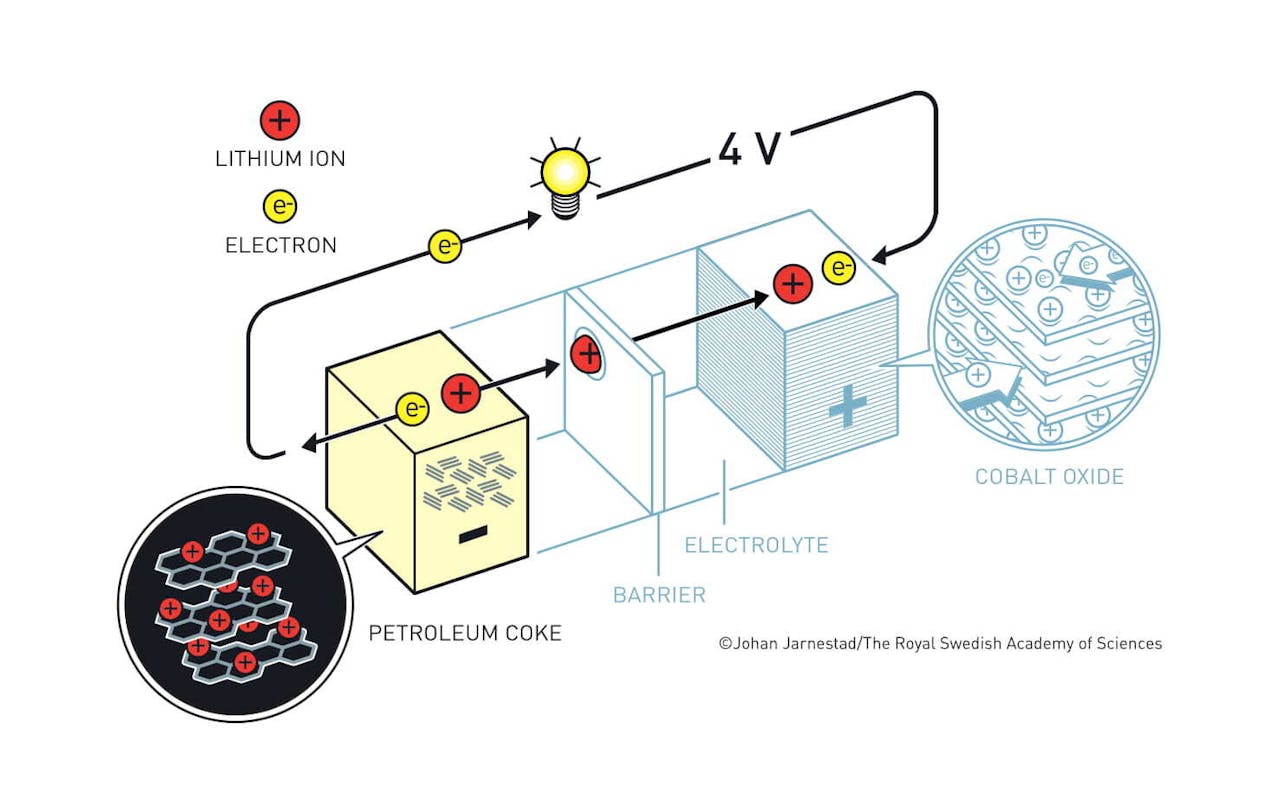
Akira Yoshino combineerde de kobaltoxide-kathode van John Goodenough met zijn petroleumcokes-anode om de eerste lithium-ion-batterij te maken die commercieel interessant was.
Johan Jarnestad/The Royal Swedish Academy of SciencesLaatste stap
De laatste stap in de ontwikkeling werd gezet door Yoshino, die in 1985 de eerste lithium-ion-batterij maakte die commercieel ook interessant was. Yoshino’s grote doorbraak was het vervangen van de lithium door zogenoemde petroleumcokes. Dit bijproduct van de olie-industrie bestaat uit allemaal laagjes koolstof, waartussen Yoshino lithium-ionen wist te stoppen. Het grote voordeel van dit materiaal was dat het niet kapot ging tijdens het ontladen of opladen, wat bij andere anodes wel gebeurde. De lithium-ionen konden gewoon weer in de gaatjes in het materiaal kruipen, zonder daarbij veel schade aan te richten.
Met deze petroleumcokes als anodes en de kobaltoxide kathode van Goodenough creëerde Yoshino een lichtgewicht batterij die vier volt aan stroom kon opwekken en veilig honderden keren opgeladen kon worden. Deze batterij was genoeg om bedrijven te interesseren, en de eerste lithium-ion-batterij verscheen in 1991 op de markt. Sindsdien blijft de techniek zich ontwikkelen en vinden we nog steeds nieuwe, betere materialen die de batterijen sterker en duurzamer maken.
Marnix Wagemaker, hoogleraar opslag van elektrochemische energie aan de TU Delft, roemt Whittingham, Goodenough en Yoshino als pioniers: “Zij waren echt de grondleggers voor dit veld, en hebben de technologie waargemaakt die we nu nog steeds gebruiken.” Volgens Wagemaker is de prijs dan ook meer dan terecht: “Hoewel we nu wel betere materialen en methoden vinden en bijvoorbeeld het kobalt proberen te vervangen omdat het niet zo duurzaam is, blijft de achterliggende techniek relevant.” Voorlopig is de oplaadbare batterij dus nog lang niet uitontwikkeld. Ook de Nobellaureaten zelf werken hier nog steeds aan mee. Zo stelde Goodenough in 2017 nog een batterij voor zonder vloeibare onderdelen, maar met vier keer de capaciteit van de huidige batterijen. Al vermoedden sceptici toen dat dit te mooi was om waar te zijn.

