In grote studies wereldwijd laten ouders het DNA van hun baby uitlezen. Zo testen wetenschappers het kind op honderden erfelijke aandoeningen. Alleen maar het allerbeste voor je kind, toch?
Iedereen wil dat zijn baby gezond is. Daarom doen we echo’s en bloedtesten tijdens de zwangerschap, en de hielprik na de geboorte. Die hielprik zoekt echter naar slechts 27 ernstige, behandelbare ziekten, terwijl er zo’n zevenduizend genetische aandoeningen bestaan. Maar nu is daar DNA-sequencing, een techniek die de genetische blauwdruk ontrafelt en daarin ziekmakende foutjes opspoort. De belofte is groot: wie wil zijn kind nu niet de beste start geven? Maar is het wel zo simpel? In het eerste deel van dit drieluik onderzoeken we wat er technisch (on)mogelijk is met DNA-sequencen en wat deze methode ons kan opleveren.
Verborgen genetische aandoeningen
De neonatale hielprikscreening spoort lang niet elke erfelijke aandoening op. Neem cystinose, een zeldzame stofwisselingsziekte waarbij aminozuren zich langzaam ophopen in het lichaam. Als baby’s zien deze kinderen er nog gezond uit, maar de langzame stapeling van stoffen beschadigt op den duur hun organen. Dat kan leiden tot nierfalen, spierzwakte en in uitzonderlijke gevallen zelfs coma. Doordat de stoffen zich bij de geboorte nog niet hebben opgehoopt, kunnen laboratoriumtesten er niet op screenen. De oorzaak van de aandoening ligt wel al vanaf het begin verankerd in een (fout) stukje DNA. Door gericht naar genetische afwijkingen te kijken, zouden deze kinderen eerder geholpen kunnen worden. Hetzelfde geldt voor een groot deel van die andere genetische ziekten, waarop we nu niet standaard testen.
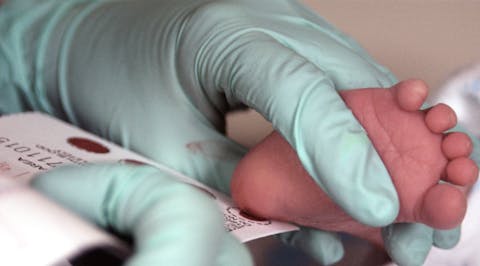
Sinds 1974 krijgen alle baby’s in Nederland de hielprik aangeboden. Daarbij wordt een beetje bloed uit de hiel op een kaartje gedruppeld voor labonderzoeken. Elk jaar spoort de hielprik bij ongeveer 225 kinderen een ernstige ziekte op. De schildklieraandoening congenitale hypothyreoïdie (CH) komt het vaakst voor, gevolgd door sikkelcelziekte en taaislijmziekte.
U.S. Air Force photo/Staff Sgt Eric T. Sheler, Public domain, via Wikimedia Commons.Dat idee leeft wereldwijd. Internationaal lopen er zo’n dertig projecten naar het sequencen van baby’s, waaronder in België, het Verenigd Koninkrijk, Australië en Amerika. De opzet en omvang tussen de studies verschilt, maar het doel is gelijk: kinderen vroegtijdig diagnosticeren en waar mogelijk behandelen. Normaal gesproken zien artsen een probleem en zoeken vervolgens naar de oorzaak van dat probleem. DNA uitlezen bij de geboorte draait dat hele proces om: het stelt artsen in staat om defecte genen op te sporen, de ziekte vast te stellen en te behandelen nog vóórdat een kind symptomen heeft.
Het volledige genetisch bouwplan, of genoom, in kaart brengen is niet nieuw, maar de techniek verbeterde flink in de afgelopen decennia. Nog maar 25 jaar geleden ontrafelden wetenschappers voor het eerst het menselijk genoom. Dat kostte hen toen dertien jaar. Nu lukt het al binnen 24 uur, met slechts één druppel bloed. Zoiets zou dus ook kunnen met het bloed van het hielprikkaartje. “Maar het uitlezen van het DNA zelf, is niet het moeilijkste of tijdrovendste deel”, zegt Lidewij Henneman, hoogleraar patiëntenperspectief bij genetisch testen aan de afdeling Humane Genetica van Amsterdam UMC. “Juist het analyseren, het interpreteren van de data, vormt de uitdaging.”
Klachten als kompas
De gezondheidszorg maakt wel al succesvol gebruik van DNA-analyses in de diagnostiek om aandoeningen van patiënten te identificeren. Het verschil tussen die diagnostiek en screening zit hem voornamelijk in het feit dat artsen de symptomen van de patiënt gebruiken als kompas. Ons hele genoom bestaat uit 3 miljard letters, ongeveer evenveel als alle letters in tweeduizend gemiddelde romans. Vermoeden artsen dat een patiënt een genetische leveraandoening heeft, dan hoeven ze niet tweeduizend boeken met genetische code door te werken, maar richten ze zich op de ‘hoofdstukken’ die over de lever gaan. Bij gezond ogende baby’s werkt dat anders. Dan kunnen wetenschappers zich niet laten leiden door symptomen, omdat die er simpelweg nog niet zijn. Ze moeten dan alle boeken doorspitten.
— Lidewij HennemanHet uitlezen van het DNA zelf, is niet het moeilijkste of tijdrovendste deel
Uiteraard kunnen onderzoekers zich richten op genen waarvan al bekend is dat fouten erin tot ziekte leiden. Klinkt simpel genoeg, toch? Dat zou het zijn, als we allemaal precies hetzelfde DNA hadden. Dan springt een afwijking er zo uit. Maar elk mens heeft uniek DNA: elk gen bevat kleine verschillen. De meeste van die variaties zijn onschuldig, maar sommige veroorzaken ziekten. En het lastige is: een ziekte ontstaat niet altijd door hetzelfde typfoutje. “Soms zijn er wel honderd varianten die tot dezelfde ziekte leiden”, vertelt Mirjam Langeveld, internist erfelijke metabole ziekten aan Amsterdam UMC en lid adviescommissies rondom neonatale screening. “Lang niet alle foutjes zijn al in kaart gebracht.”
Nog niet in het standaardprogramma
Uiteindelijk zijn we voor deze technologie afhankelijk van de bestaande kennis. “Dat betekent dat je bij het screenen van gezonde baby’s alleen die kinderen eruit pikt met een genetische fout die we al kennen”, zegt Langeveld. Zelfs dan blijft het lastig, want niet elk foutje in een gen leidt tot even ernstige klachten. Zeker bij metabole ziekten loopt dat uiteen van heel vroege, ernstige kinderziekten tot een mildere vorm van de aandoening die zich later in het leven openbaart. Terwijl ze toch allemaal door fouten in hetzelfde gen worden veroorzaakt.
Tegelijkertijd helpt het grootschalig DNA-onderzoek juist die kennishiaten te vullen. Hoe meer baby’s (of mensen in het algemeen) wetenschappers sequencen, hoe groter de databank met genetische variaties wordt. Op die manier leren onderzoekers steeds meer over alle mogelijke variaties die tot genetische aandoeningen leiden. Dat versnelt onderzoek en helpt artsen in de toekomst mogelijk ook betere diagnoses te stellen.
Het grote voordeel van DNA-sequencing: je kunt in één keer op veel meer aandoeningen testen en – waar mogelijk – direct beginnen met behandelen. Maar de interpretatie van genetische informatie blijft lastig. De uitkomst van een test zegt niet altijd of een kind écht ziek zal worden, en al helemaal niet hoe ernstig.

Ons DNA bestaat uit vier bouwstenen die we voor het gemak noteren als A, T, C en G. Zou je al die letters achter elkaar uitschrijven, heb je daar ongeveer tweeduizend boeken voor nodig.
Ian Glover, CC-by-nc 2.0 via Flickr.Toch vindt het Verenigd Koninkrijk de lopende Engelse Generation Study onder honderdduizend baby’s nu al zo overtuigend, dat het land vanaf 2030 elke pasgeboren baby standaard wil laten sequencen. In Nederland is het nog lang niet zo ver, volgens Henneman. “Het volledig in kaart brengen van het genoom van ‘gezonde’ baby’s is hier, door alle onduidelijkheden, nog echt een brug te ver. Daarom zal dat voorlopig niet in het standaard screeningprogramma opgenomen worden.”
Je kindje in kaart
Het DNA van je baby laten uitlezen om genetische aandoeningen zo vroeg mogelijk op te sporen en te behandelen. In sommige landen nog experimenteel, terwijl het Verenigd Koninkrijk al vanaf 2030 zo’n genetische screening standaard wil invoeren. De belofte is groot: wie wil zijn kind nu niet de beste start geven? Maar is het wel zo simpel?

