Bij menselijke embryo’s is een hartkwaal gerepareerd die door één defect gen wordt veroorzaakt. De gen-techniek blijkt verrassend trefzeker. De embryo’s mochten trouwens niet opgroeien tot gezonde baby’s, maar werden na enkele dagen vernietigd.
De hartkwaal hypertrofische cardiomyopathie is een erfelijke afwijking waardoor de drager een groot risico loopt op een plotselinge, fatale hartstilstand op jonge leeftijd. De aandoening is te wijten aan één defect gen, en erft dominant over. Dit betekent, dat iemand de kwaal al heeft als slechts één van beide kopieën van het gen defect is. Dat maakt hypertrofische cardiomyopathie in principe zeer geschikt voor genetische reparatie.
Een groot, internationaal team van onderzoekers heeft nu met succes menselijke embryo’s die dit gen-defect hadden, met de Cripr-Cas-techniek van een gezond gen voorzien. Cripr-Cas is een nieuw soort gereedschap om genetisch te modificeren. De toegepaste reparatie lukte bij de helft van de behandelde embryo’s, en wellicht nog belangrijker: in geen enkel embryo kwam het nieuwe gen op een verkeerde plek in het DNA terecht.
Het was al langer duidelijk dat Crispr-Cas potentieel fantastische mogelijkheden biedt om aan levende wezens te sleutelen. Maar Chinese onderzoekers die eerder probeerden om menselijke embryo’s genetisch te modificeren, haalden maar een heel laag succespercentage. In de meeste gevallen kwam het gen op de verkeerde plek in het DNA terecht. Een ander euvel was mozaïcisme: in veel behandelde embryo’s waren sommige cellen van het embryo wel gerepareeerd, andere niet. Bij fruitvliegjes of zebravissen – veel gebruikte proefdieren – is dat geen groot probleem, maar wel als je honderd menselijke embryo’s moet behandelen om er één te kunnen terugplaatsen in de moeder.
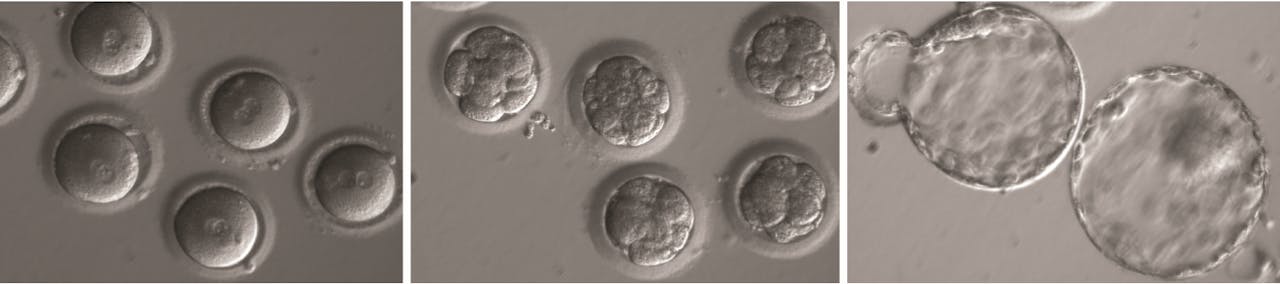
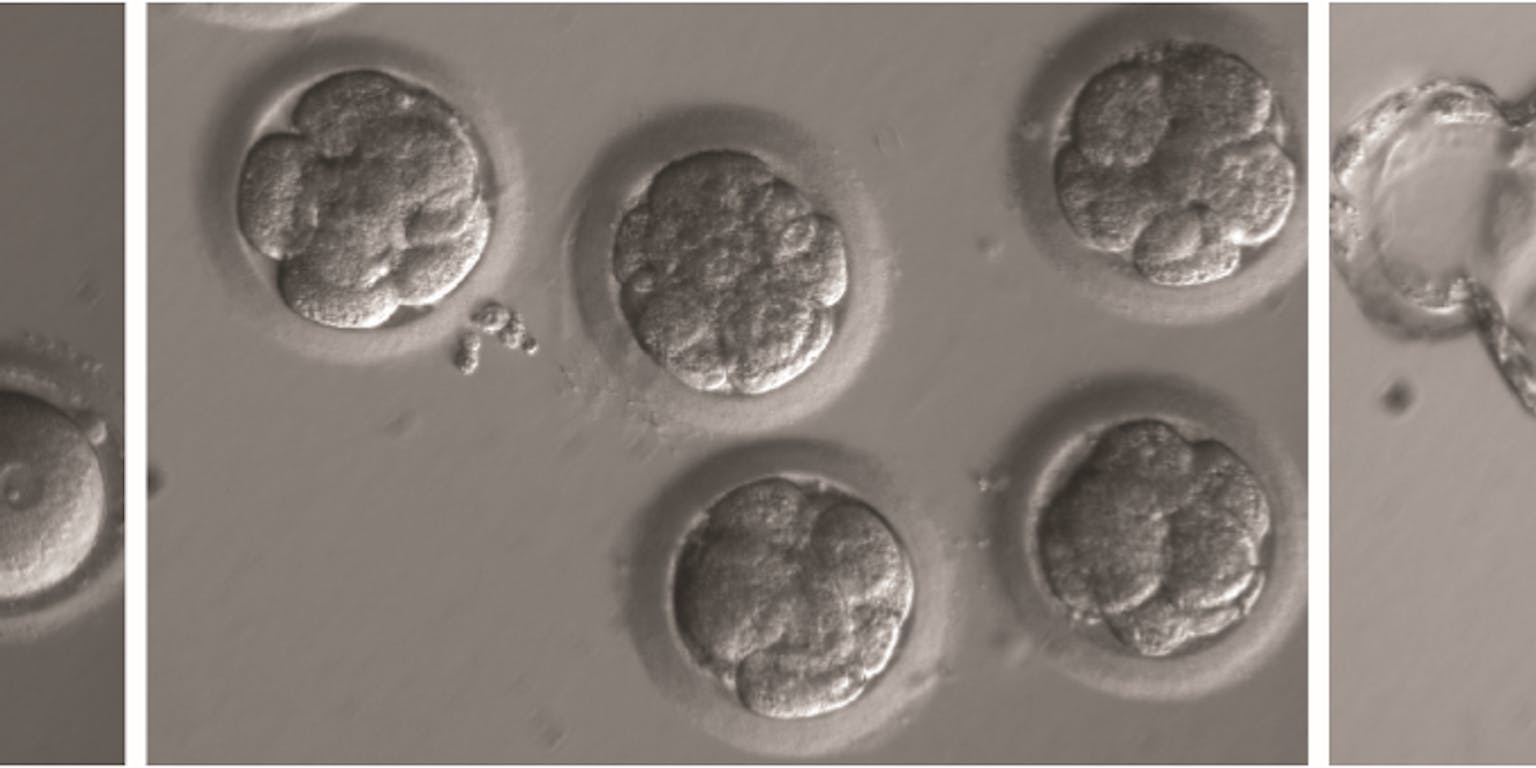
Links: de zojuist bevruchte en met Crispr-Cas behandelde eicellen, midden: het stadium met acht cellen, rechts: het blastocyst-stadium, als het embryo al een klompje van diverse types cellen is geworden.
Nature, Hong MaIn vitro
Deze experimenten gebeuren in vitro (in de reageerbuis) met zeer jonge embryo’s, die uit maar een handjevol cellen bestaan. De embryo’s ontstaan ook in de reageerbuis, door een eicel te injecteren met sperma, een procedure die al op grote schaal wordt toegepast bij IVF, voor vrouwen die niet op de natuurlijke manier zwanger raken.
Waarom lukte de genetische reparatie door dit team zoveel beter? “Dit keer zijn de embryo’s in een nog vroeger stadium behandeld, tegelijk met het injecteren van het sperma”, zegt Sjoerd Repping, hoofd van het centrum voor voortplantingsgeneeskunde aan het AMC die niet betrokken was bij het onderzoek, desgevraagd.
In dit geval waren alle eicellen gezond, en bevatte het sperma het defecte gen. Samen met het sperma werd het Crispr-Cas ‘gereedschap’ geïnjecteerd. Dit knipt het DNA van de bevruchte eicel – dat inmiddels het defecte gen bevat – op de juiste plek doormidden, waarna de cel zelf de breuk repareert, maar met een kopie van het gezonde gen.
De embryo’s mochten zich vervolgens enige dagen ontwikkelen, tot het blastocyst-stadium. Het embryo is dan een klompje cellen waarin al verschillende celtypes te onderscheiden zijn, waaruit later de diverse organen ontstaan. Zo is na te gaan, of de normale ontwikkeling niet verstoord is door de ingreep.
In de helft van de gevallen lukte de reparatie. De overige embryo’s hadden het defecte gen nog. Als deze techniek ooit gebruikt wordt om baby’s ter wereld te brengen, moeten de embryo’s dus genetisch getest worden alvorens ze terug te plaatsen in de moeder (of een draagmoeder).
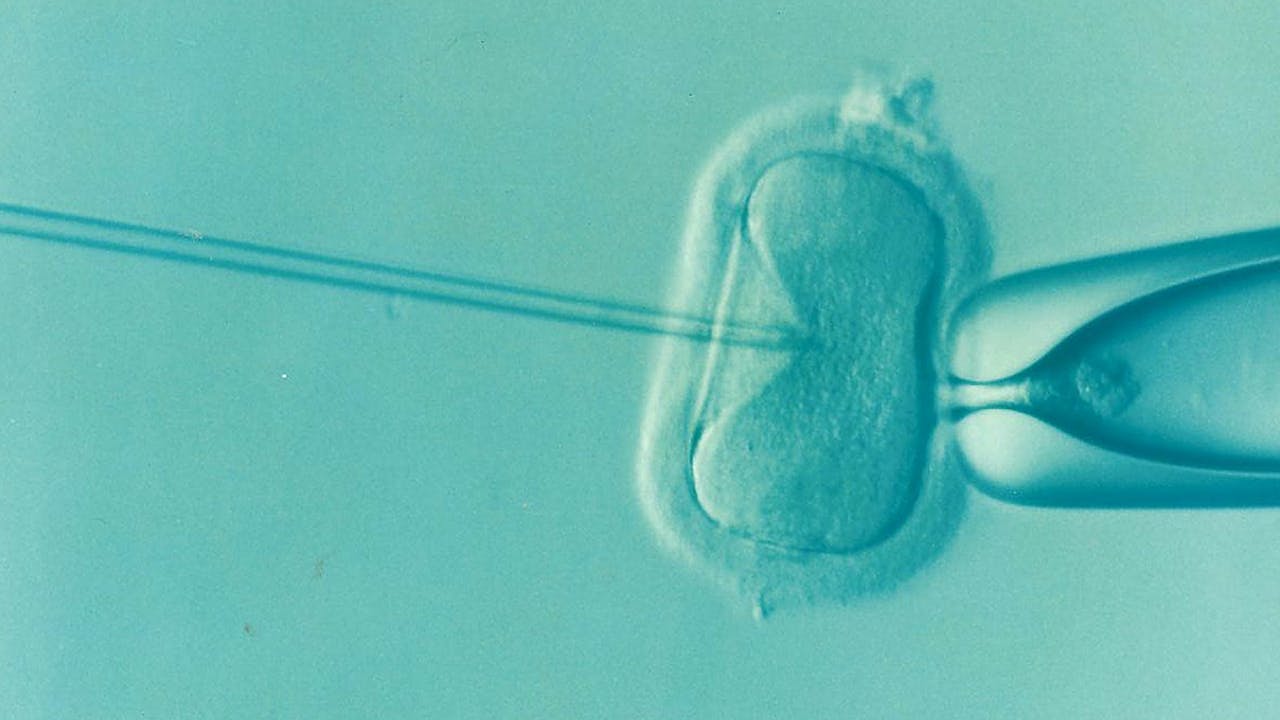
Bij IFV kan bevruchting van de eicel spontaan in de reageerbuis tot stand komen, of door injectie van het erfelijk materiaal. Met dezelfde injectie kan ‘gereedschap’ voor genetische modificatie in de cel gebracht worden.
PixabayPre-implantatie diagnostiek
Dit is echter geen probleem; het testen van embryo’s (door er één cel uit weg te halen voor analyse) gebeurt nu ook al, als bij IVF zogeheten pre-implantatie diagnostiek wordt gedaan. Van ouders met een genetische afwijking worden dan via IVF diverse eicellen bevrucht, en men laat het toeval zijn werk doen: sommige embryo’s zullen het defecte gen wel hebben, andere niet. Een gezond embryo wordt in de moeder teruggeplaatst, de ‘foute’ worden weggegooid.
Door ‘foute’ embryo’s te repareren, hoeven er bij IVF met pre-implantatie diagnostiek minder te worden aangemaakt, en ook minder weggegooid. In Nederland gaat het om enige honderden IVF-embryo’s per jaar. Repping gelooft dat de Crispr-Cas techniek veilige resultaten oplevert: “Uit deze embryo’s was zeer waarschijnlijk een gezond kind geboren.” Maar het is nog in geen enkel land legaal, om genetisch gemodificeerde embryo’s ook terug te plaatsen en de baby ter wereld te laten komen.
Ook zonder terugplaatsing zou dit experiment nu in Nederland niet mogen, omdat hierbij nieuwe embryo’s ontstaan. In Nederland mogen alleen ‘restembryo’s’, die zijn overgebleven van IVF-behandelingen, gebruikt worden voor experimenten.
In de Verenigde Staten mag je wel nieuwe embryo’s creëeren speciaal voor onderzoek, mits er op geen enkele manier overheidsgeld voor de experimenten wordt ingezet. Dat was de knieval die president George Bush destijds deed naar de christelijke conservatieven in zijn achterban.
Ook in Nederland?
Repping is voorstander van een verruiming van de regels in Nederland, zodat deze experimenten ook hier toegelaten worden. Zelfs het terugplaatsen van gerepareerde embryo’s zou op termijn niet moeten worden uitgesloten, vindt hij. Nu het mogelijk is gebleken, zo redeneert Repping, zal het elders in de wereld toch wel gebeuren. Nederlandse ouders die een genetisch gerepareerd embryo nodig hebben, gaan dan naar het buitenland.
Maar het is een lastig moment om te pleiten voor verruiming van de regels op dit gebied. Immers, momenteel tracht men in Den Haag een kabinet in elkaar te knutselen met deelname van de Christen Unie, die zeer afwijzend staat tegen alles wat doet denken aan ‘voor God spelen’.
En daar moet D66 mee aan de onderhandelingstafel, een partij die wat dat betreft veel liberaler is. D66 heeft zelfs een senator in de Eerste Kamer, Annelien Bredenoord, die als medisch-ethicus nauw betrokken is bij de discussies onder wetenschappers en beleidsmakers over gentechniek.
Repping heeft regelmatig contact met politici over dit hete hangijzer: “Ik voer al twintig jaar ook met politici uit de streng christelijke hoek gesprekken, en ik heb al die tijd geen spoortje beweging in hun standpunten ontdekt. Op zich wel begrijpelijk, want voor hen is dit geen discussie over proportionaliteit – of het gebruikte middel wel in verhouding staat tot de mogelijke voordelen – maar over principes.”