Crispr, de nieuwe gentechniek die hele populaties kan ‘besmetten’ met een vreemd gen, heeft enorme mogelijkheden en enorme gevaren. Er is nu een ‘tegengif’ gevonden, dat een uit de hand lopende genetische kettingreactie kan stoppen. Dat maakt Crispr veiliger en beter toepasbaar buiten het laboratorium.
Een paar jaar geleden ontdekten genetici Crispr, een nieuw soort gereedschap om dieren (dus ook mensen) genetisch te modificeren. Met Crispr werd het mogelijk om veel gerichter en trefzekerder dan voorheen een gen naar keuze in het DNA van een organisme in te bouwen. Terwijl de oudere genetische modificatie lijkt op blind met een hagelgeweer schieten op het DNA, is Crispr eerder schieten met een geweer met telescoopvizier.

Aedes aegypti, een van de muggensoorten die een mens kan besmetten met de malariaparasiet. Dankzij de Crispr-techniek, gecombineerd met een gene drive, kan één malariaresistente mug in principe de hele muggenpopulatie in een regio resistent maken, waardoor de malariaparasiet uitgeroeid wordt. Maar op zo’n ‘genetische kettingreactie’ zat tot nu toe geen stopknop.
George Poinar et al., 2020. Priscoculex burmanicus n. gen. et sp. (Diptera: Culicidae: Anophelinae) from mid-Cretaceous Myanmar amber, Historical Biology, CC BY 4.0Genetisch besmetten
Crispr werd door het toonaangevende blad Science uitgeroepen tot dé wetenschappelijke doorbraak van 2015, en ook afgelopen jaar waren er telkens nieuwe successen met Crispr te melden. Maar de techniek is potentieel ook zeer gevaarlijk. Crispr is namelijk relatief eenvoudig uit te breiden tot een gene drive, een genetische truc waardoor alle nakomelingen van het gemodificeerde organisme dezelfde modificatie hebben, en ook alle nakomelingen daarvan. In principe kan één organisme met zo’n gene drive dat in de vrije natuur terechtkomt – bedoeld of onbedoeld – de hele populatie besmetten met het vreemde gen. De onderzoekers die dit bedachten, noemden dit zelf een genetische kettingreactie, en riepen op om voorlopig met dit soort onderzoek te stoppen. Niettemin is dit zelfs al bij menselijke embryo’s uitgeprobeerd.
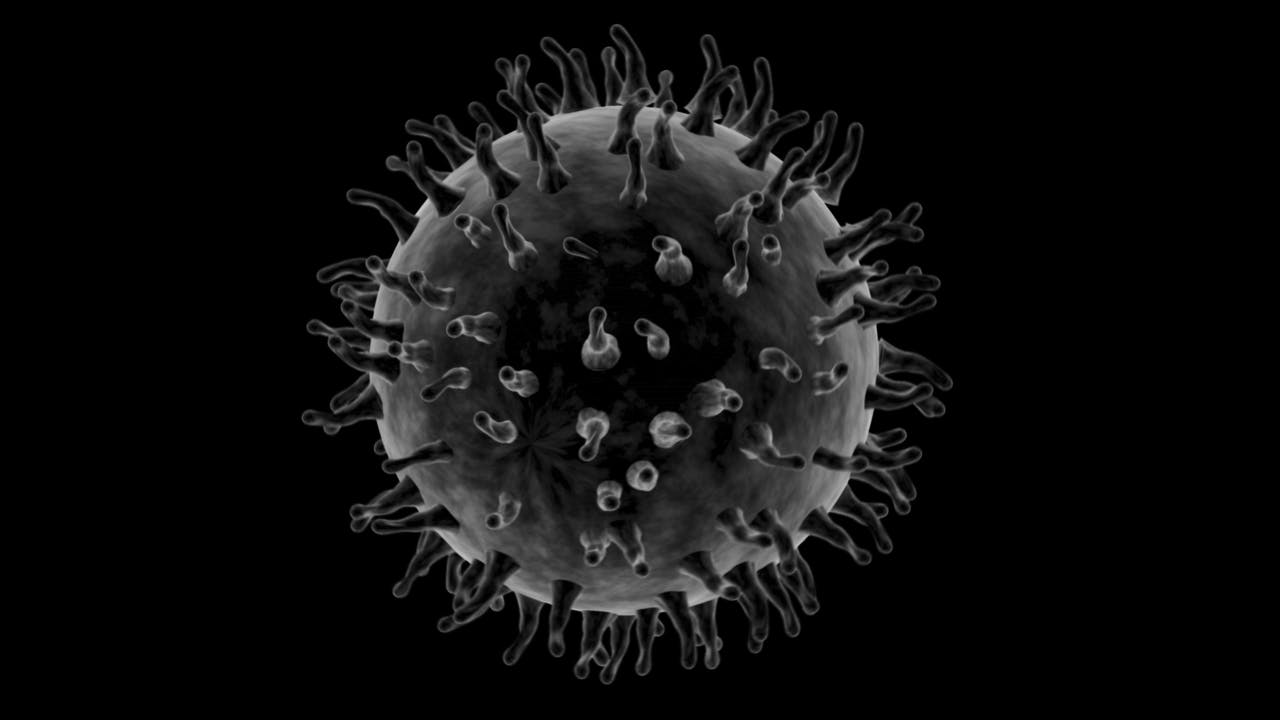
Een virusdeeltje. Bacteriën verdedigen zich tegen infectie met een virus door het DNA van het virus op een specifieke plek door te knippen. Dit is de basis voor de Crispr-techniek voor genetische modificatie. Het virus bestrijdt die verdediging weer met eiwitten die het knippen dwarszitten. Dit kan de basis vormen voor een ‘stopknop’ voor de Crispr-techniek.
Fast Facts, toestemming van Gijs Wuite voor gebruik op Nemo KennislinkAnti-Crispr
In vakblad Cell rapporteren onderzoekers uit San Francisco nu, dat ze diverse anti-Crispr-eiwitten ontdekt hebben. Heel verrassend is dit niet; Crispr is afgekeken van bacteriën, die deze techniek gebruiken om het DNA stuk te knippen van virussen (bacteriofagen) die proberen hen te infecteren. Maar de evolutionaire wapenwedloop stopt nooit: er blijken bacteriofagen te bestaan die eiwitten produceren om het bacteriële Crispr-mechanisme onklaar te maken.
De onderzoekers ontdekten vier anti-Crispr-eiwitten door systematisch het DNA van zo veel mogelijk soorten bacteriofagen te doorzoeken. De bacteriofaag Listeria monocytogenes blijkt, eenmaal geïnfiltreerd in een bacterie, eiwitten aan te maken die het Crispr-mechanisme tegenwerken. Ook toonde het team aan, dat deze eiwitten daadwerkelijk de Crispr-techniek dwarsbomen in Colibacteriën en menselijke cellen. Vanwege het overduidelijke evolutionaire voordeel dat ze bacteriofagen opleveren, verwachten de onderzoekers dat er nog meer anti-Crispr-eiwitten te vinden zijn in andere soorten.
Resistente kakkerlak
Dat er een ‘stopknop’ voor Crispr en de gene drive bestaat, is goed nieuws voor toekomstige toepassingen. In het laboratorium is al aangetoond, dat één mannelijke malariamug die resistent is gemaakt tegen de malariaparasiet, in principe een hele populatie resistent kan maken. In dit geval is het juist de bedoeling dat je met het uitzetten in de natuur van een handjevol muggen een hele streek in een paar jaar malariavrij maakt. Maar in andere gevallen zou het ontsnappen uit het laboratorium van één dier – bijvoorbeeld een kakkerlak die resistent is gemaakt tegen veelgebruikte bestrijdingsmiddelen – een genetische kettingreactie in gang zetten die niet meer te stoppen is.
Hoewel de genetische basis voor de anti-Crispr-eiwitten nog niet precies bekend is, verwachten de onderzoekers dat het mogelijk zal zijn om in _gene drive_-organismen een stop-knop genetisch in te bouwen. Ook los van het ontsnappingsrisico kan zo’n stop-knop handig zijn. Als het Crispr-mechanisme te lang in een cel werkzaam blijft, is er een grotere kans dat het vreemde gen ook op plaatsen wordt ingebracht waar het niet bedoeld is, en niet goed functioneert. “Het is van belang om de overvloed aan gereedschappen te benutten die de wapenwedloop tussen bacteriofagen en bacteriën ons verschaft,” concluderen de onderzoekers.

