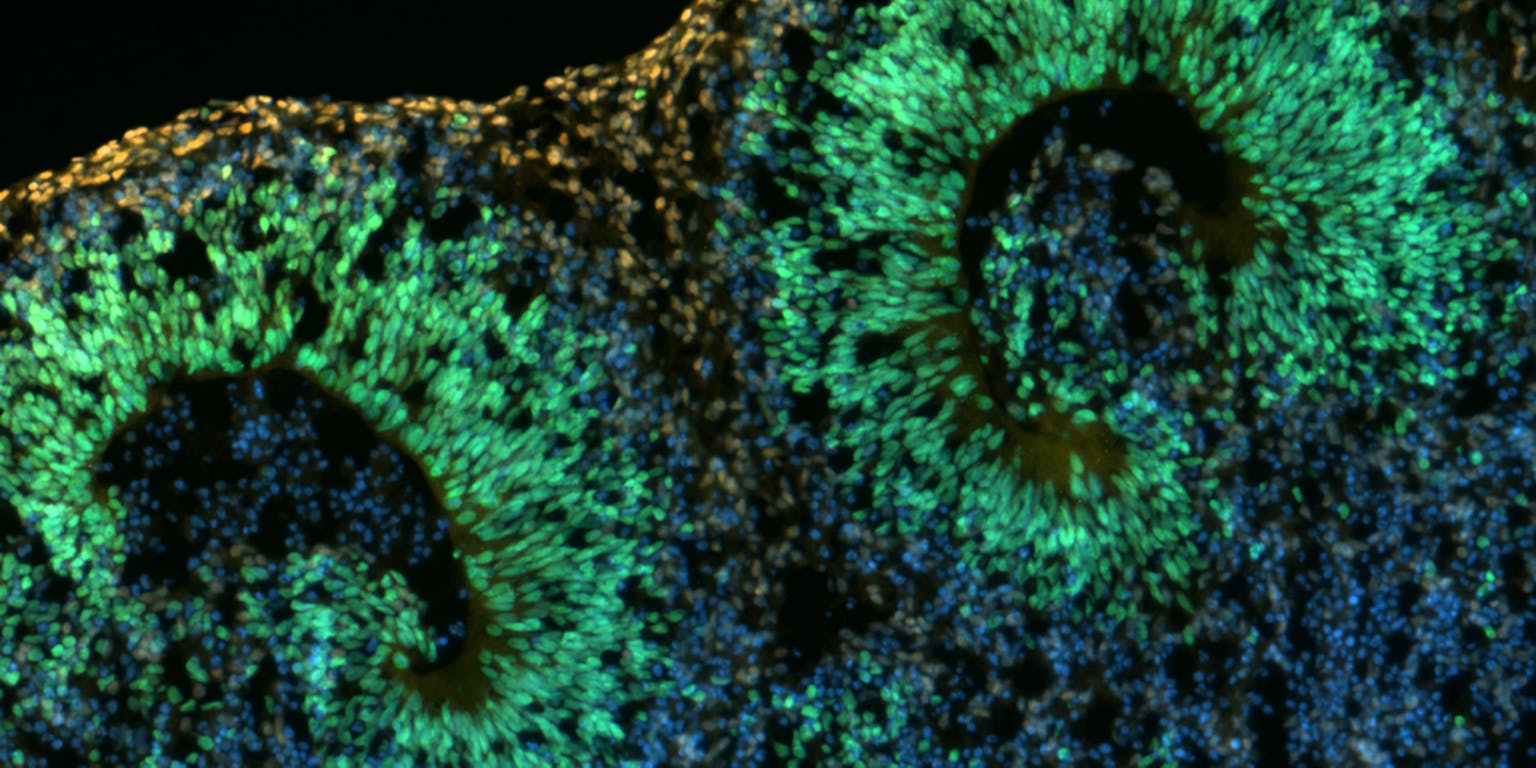
Emma (4) en Joeri (16) hebben een zeldzame genetische afwijking die er onder andere voor zorgt dat ze problemen hebben met spraak en taal. Hoe leidt een mutatie van een bepaald gen tot een afwijkende hersenontwikkeling? Die vraag probeert geneticus Joery den Hoed te beantwoorden met in het lab gekweekte hersencellen.
Afgelopen mei vielen na een zoektocht van jaren de puzzelstukjes voor Gerita uit Duiven op hun plek: haar dochter Emma (4) heeft het syndroom van Snijders Blok-Campeau. “Eindelijk duidelijkheid, al Emma’s klachten passen erbij.” Lange tijd gaf haar moedergevoel al aan dat er meer aan de hand was. Motorisch ontwikkelde Emma zich traag, ze had forse eetproblemen en met twee jaar sprak ze nog maar enkele woordjes. Uit het genetische WES-onderzoek, waarbij naar alle twintigduizend genen wordt gekeken, bleek dit voorjaar dat Emma een mutatie heeft in het gen CHD3.
Deze genetische afwijking is pas sinds enkele jaren bekend bij onderzoekers. Hoewel zij in eerste instantie dachten dat een foutje in dit gen alleen leidde tot spraak- en taalproblemen, bleek het uiteindelijk om een syndroom te gaan. “Deze kinderen hebben bijna allemaal ook een verstandelijke beperking en sommige hebben een autismespectrumstoornis,” vertelde onderzoeker Lot Snijders Blok eerder aan NEMO Kennislink. “Ook heeft twee derde van de kinderen een vergroot hoofd.”
Joeri (16) uit Apeldoorn was al 13 toen hij de diagnose kreeg, als een van de eersten. “Fijn om te weten dat het echt iets is”, zegt zijn moeder Olga, die net als Gerita lid is van een internationale Facebookgroep waarbij inmiddels de ouders van 26 CHD3-kinderen zijn aangesloten. Ook Joeri kampt al vanaf zijn geboorte met een motorische en verstandelijke achterstand, al gaat het met hem relatief goed. Olga: “Onderling is er volgens mij veel verschil in ontwikkeling. Joeri heeft nog steeds een leerachterstand en lezen kost hem veel moeite. Maar doordat hij nu 1.91m is, valt zijn grote hoofd niet meer zo op. En pas als je langer met hem omgaat, merk je dat hij door de slappe mondspieren wat onduidelijk spreekt en nog wat kinds is.”
Van genen naar hersenen
Inmiddels zijn er al heel wat symptomen van het syndroom bekend, maar er is ook nog altijd veel onduidelijk. Snijders Blok: “We weten dát er iets misgaat in de ontwikkeling, maar niet precies wát.” Die vraag probeert geneticus Joery den Hoed te beantwoorden in het lab van het Nijmeegse Max Planck Instituut voor Psycholinguïstiek (MPI). Hij kweekt uit stamcellen hersencellen die zich ontwikkelen tot een 3D-structuur (een ‘organoïde’) die vergelijkbaar is met de vroege embryonale hersenontwikkeling. Aan de hand van deze organoïden hoopt hij te zien hoe een mutatie in het CHD3-gen leidt tot een afwijkende hersenontwikkeling. “Misschien kan een stamcel door die mutatie niet meer doorontwikkelen in een hersencel, of misschien gebeurt dat juist veel sneller”, aldus Den Hoed.

Joery den Hoed aan het werk in het lab in Dresden.
Joery den HoedToen Den Hoed ruim twee jaar geleden begon aan zijn promotie-onderzoek werkte het moleculair biologisch laboratorium van het MPI nog niet met organoïden. “Ik ben daarom in mijn eerste jaar een paar maanden naar Dresden geweest om de techniek te leren bij het Max Planck Instituut voor Moleculaire Celbiologie en Genetica. Daarna hebben we hier de methode opgezet.”
Een extra dimensie
De methode begint met huid- of bloedcellen, afgenomen bij CHD3-patiënten of – ter vergelijking – bij gezonde proefpersonen. Deze cellen worden omgezet naar stamcellen, een soort basiscel die nog in andere celtypen kan veranderen. “Dat omzetten is inmiddels een standaardprocedure. Dat doen we niet eens zelf, maar laten we doen door een faciliteit die de meeste universiteiten tegenwoordig hebben. Dat kost een paar weken.”
Die stamcellen laten de onderzoekers vervolgens in een petrischaaltje groeien. Tot voor kort ontwikkelden ze zich daar ook verder tot neuronen, oftewel hersencellen, maar de structuur die dan ontstaat is volledig plat. “Dat is één laagje cellen, niet te vergelijken met de driedimensionale structuur van een normaal ontwikkelend brein. Daarom verplaatsen we de cellen nu naar een plaat met kleine kuiltjes. Daarin zit een laagje dat ervoor zorgt dat de cellen niet aan de bodem hechten. Ze vormen daarin een balletje, een embryoid body.”
Die 3D-structuur voedt Den Hoed vervolgens met een zogeheten medium met een specifieke samenstelling van groeifactoren, nutriënten en hormonen. Dat duwt de ontwikkeling van de cellen in een bepaalde richting, waardoor ze neuronale stamcellen worden. Deze zijn onder de microscoop te zien als een lichte laag aan de buitenkant. Deze techniek voor het kweken van organoïden werd in 2013 voor het eerst beschreven door een groep Oostenrijkse en Britse onderzoekers.
De rol van CHD3
“We verplaatsen de plaat dan naar een orbital shaker, een soort roterend platform dat de cultuur in beweging houdt. Zo komen er voldoende zuurstof en voedingsstoffen bij de cellen om verder te groeien.” Dan is het een kwestie van de cellen levend houden en wachten. Na drie tot vier weken beginnen de organoïden een soort ventrikels te vormen met neuronale stamcellen in het midden. “Uit die stamcellen ontwikkelen neuronen, die naar de buitenkant van de ventrikels gaan. Dat proces is vergelijkbaar met wat je in een echt ontwikkelend brein ziet.”
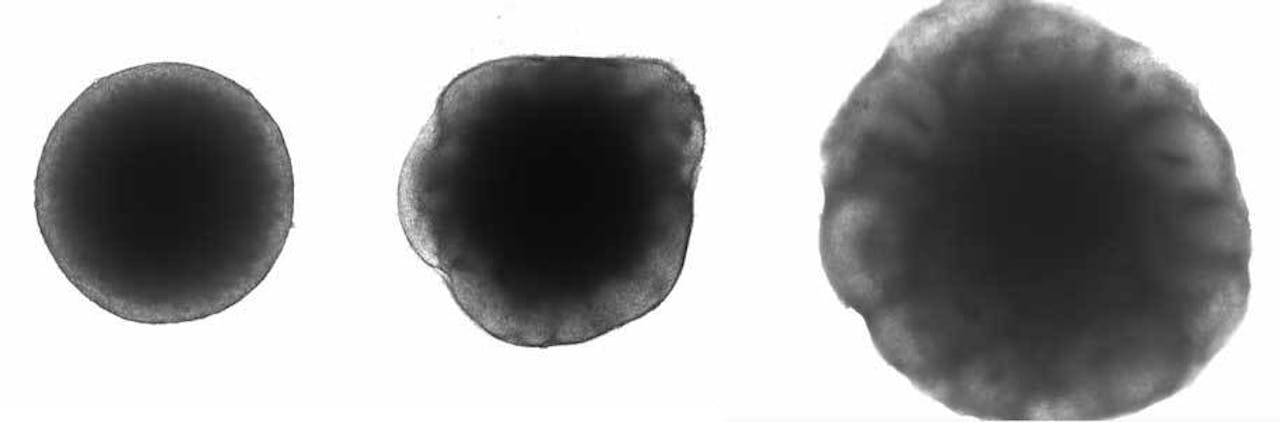
V.l.n.r. Een embryoid body na zes dagen in het medium, na twaalf dagen in het medium (met lichte neuronale stamcellen aan de buitenkant), en een organoïde van twintig dagen oud met ventrikels aan de buitenkant.
Joery den HoedIn een echt embryonaal brein ligt echter vast in welke richting de neuronen zich ontwikkelen. Zo ontstaat er elke keer weer een brein dat ongeveer op dezelfde manier georganiseerd is en er hetzelfde uitziet. “Bij een organoïde heb je geen controle over de vorm. Elk organoïde heeft meerdere ventrikels, maar die zitten nooit op precies dezelfde plek en zijn niet van dezelfde grootte. De processen die binnen zo’n ventrikel plaatsvinden zijn echter wel vergelijkbaar met die in een ontwikkelend embryo.” Zo zien de onderzoekers toch hoe specifieke genen bijdragen aan die ontwikkeling.
“We denken dat CHD3 een rol speelt bij de ontwikkeling van neuronale stamcel naar neuron”, vertelt Den Hoed. “Als die stamcel verandert in een neuron begint de expressie van CHD3. Daarvoor stond dat gen nog uit, maar het gaat dan aan en helpt ervoor te zorgen dat die neuronale stamcel een neuron kan worden.” Bij een mutatie in het CHD3-gen gaat die overgang mis, vermoeden de onderzoekers. “Misschien lukt dat helemaal niet meer of misschien gaat het juist veel sneller. Daar hopen we een verschil te zien, maar zo ver zijn we nu nog niet.” Tot nu toe heeft Den Hoed alleen organoïden van gezonde stamcellen gekweekt. De komende tijd gaat hij aan de slag met stamcellen van CHD3-patiënten.
Brein uit het lab
Het duurt steeds vijftig tot zeventig dagen tot een organoïde zo ver ontwikkeld is dat Den Hoed het kan analyseren. “Als je alleen geïnteresseerd bent in hoe een neuronale stamcel werkt, kun je al na twee of drie weken aan de slag. Anderen laten het organoïde een half jaar of zelfs meer dan een jaar groeien. Dan zie je hoe neuronale netwerken zich ontwikkelen.”
Dat laatste deden Amerikaanse onderzoekers, die daarmee onlangs het nieuws haalden. Zij wisten de elektrische activiteit in zo’n netwerk te matchen met gemeten hersenactiviteit bij premature baby’s (van 25 tot 38 weken). “Die onderzoeksgroep is sowieso goed in het creëren van media-aandacht; eerder wilden ze ook organoïden kweken in de ruimte, zonder zwaartekracht”, reageert Den Hoed nuchter. “Maar dit is zeker een interessante ontwikkeling. Knap dat ze de indirecte EEG-meting op de schedel hebben gekoppeld aan de direct gemeten activiteit in de organoïden.”
Brug tussen genetica en hersenontwikkeling
Hoewel de organoïden zo steeds meer doen denken aan echte mini-breintjes, is het volgens Den Hoed nog lang niet zo ver dat we kunnen spreken van een brein uit het lab. Hij vraagt zich af of het überhaupt zo ver zal komen: “Een echt brein heeft invoer van buitenaf nodig om netwerken te vormen en te rijpen. Die interactie met de omgeving begint al in de baarmoeder. In het lab ontbreekt dat, daar is alleen willekeurige activiteit.”
Gerita en Olga zijn blij met al het Nijmeegse onderzoek naar het CHD3-gen. “Hopelijk kunnen we zo meer te weten komen wat we nog kunnen verwachten in de toekomst”, zegt Gerita. “Alles is mooi meegenomen – we worden er alleen maar wijzer van.” Ook Olga hoopt op antwoorden voor de toekomst: “Wat zijn reële toekomstverwachtingen? Is er een verhoogde kans op andere medische afwijkingen? En leiden de verschillende CHD3-mutaties tot verschillende ontwikkelingspatronen?” De antwoorden op deze vragen laten nog even op zich wachten, maar met de ontwikkeling van organoïden wordt nu de eerste voorzichtige stap gezet in de overbrugging van genetica naar hersenontwikkeling.