Water is een zuivere stof. Dat betekent dat alle watermoleculen gelijk zijn. Zo staat het in de scheikundeboeken. Maar eigenlijk is dat niet helemaal waar. Er zijn allerlei verschillende watermoleculen, die we zonder nadenken met bekers tegelijk opdrinken.
Dat komt omdat er van vrijwel alle elementen verschillende isotopen bestaan. Alleen al van waterstof zijn er drie: het ‘gewone’ waterstof (H-1), daarnaast deuterium (H-2) en tenslotte het radioactieve tritium (H-3). Ze verschillen in het aantal neutronen in de kern (respectievelijk nul, één en twee), maar hebben alle drie één proton en één elektron.
Jarenlang werd in de scheikunde nauwelijks aandacht geschonken aan verschillende isotoopsamenstellingen in een stof. De overheersende gedachte was dat alle isotopen hetzelfde reageren, aangezien ze hetzelfde aantal elektronen hebben. Maar sinds de isotoopsamenstelling heel nauwkeurig kan worden bepaald, blijkt dat niet helemaal waar te zijn. Bij allerlei reacties en processen in de natuur blijkt het wel degelijk uit te maken welk isotoop van waterstof (maar ook van zuurstof of koolstof) betrokken is.
D2O en HTO
Neem bijvoorbeeld zwaar water, dat heeft duidelijk afwijkende eigenschappen. Het bestaat uit watermoleculen met twee deuteriumatomen in plaats van de normale waterstofatomen. Daardoor is het ruim tien procent zwaarder – de molmassa is 20 in plaats van 18. En dat betekent een hoger kookpunt van 101,4 °C, en een smeltpunt van 3,4 °C. Dit zware water, D2O, wordt in sommige kernreactoren gebruikt om neutronen te remmen.
Bij een ander soort zwaar water is één van de waterstofatomen vervangen door een tritium-atoom. HTO zogezegd. Dat tritiumatoom is radioactief. Het wordt in de atmosfeer gemaakt door kosmische straling, en het valt vrij snel weer uit elkaar. In twaalf jaar is de helft nog over. HTO is dus vooral te vinden in regen- en oppervlaktewater.
Het bepalen van de hoeveelheid tritium in water biedt hierdoor de mogelijkheid te bepalen of bronwater echt uit een diepe bron komt, of gewoon van leidingwater is gemaakt. En het lukt met deze bepaling ook om te onderzoeken of wijn echt zo oud is als op het etiket beweerd wordt. Druiven bevatten grotendeels vers regen- en grondwater, maar eenmaal in de fles loopt het tritiumgehalte langzaam terug. En dat tempo kan geen fraudeur versnellen.
Lichte en zware regen
Nederlandse regen bestaat uit water met een lagere molecuulmassa dan regenwater uit de tropen. Dr. Kay Beets, onderzoeker bij het isotopenlab van de afdeling geologie van de Vrije Universiteit, houdt zich veel bezig met isotopenchemie. Hij maakt bij zijn onderzoek vaak gebruik van het feit dat de verhouding van isotopen van een bepaald element niet overal precies gelijk is.
Beets vertelt: “Iedereen kent wel die plaatjes in leerboeken over de waterkringloop op aarde: water verdampt uit de oceaan, regent op het land, enzovoort. Uit die plaatjes wordt altijd iets weggelaten. Het meeste (oceaan)water verdampt in de tropen, en voordat het als regen terugvalt, daar of ergens anders, is het meestal tientallen keren gecondenseerd tot wolken waterdruppeltjes en weer verdampt tot waterdamp – zonder ooit de aarde te bereiken.”
Dit atmosferische proces is overbodig om de waterkringloop te begrijpen. Maar voor isotopenchemici is het de sleutel voor het begrijpen van de verschillen in molecuulmassa van regenwater. Het proces lijkt heel sterk op wat scheikundigen ‘gefractioneerde destillatie’ noemen. Dat vindt bijvoorbeeld plaats in olieraffinaderijen om de bestanddelen van aardolie te scheiden. Zware moleculen condenseren gemakkelijk en komen laag in de destillatiekolom terecht, lichte moleculen verdampen gemakkelijk en komen hoog in de kolom.
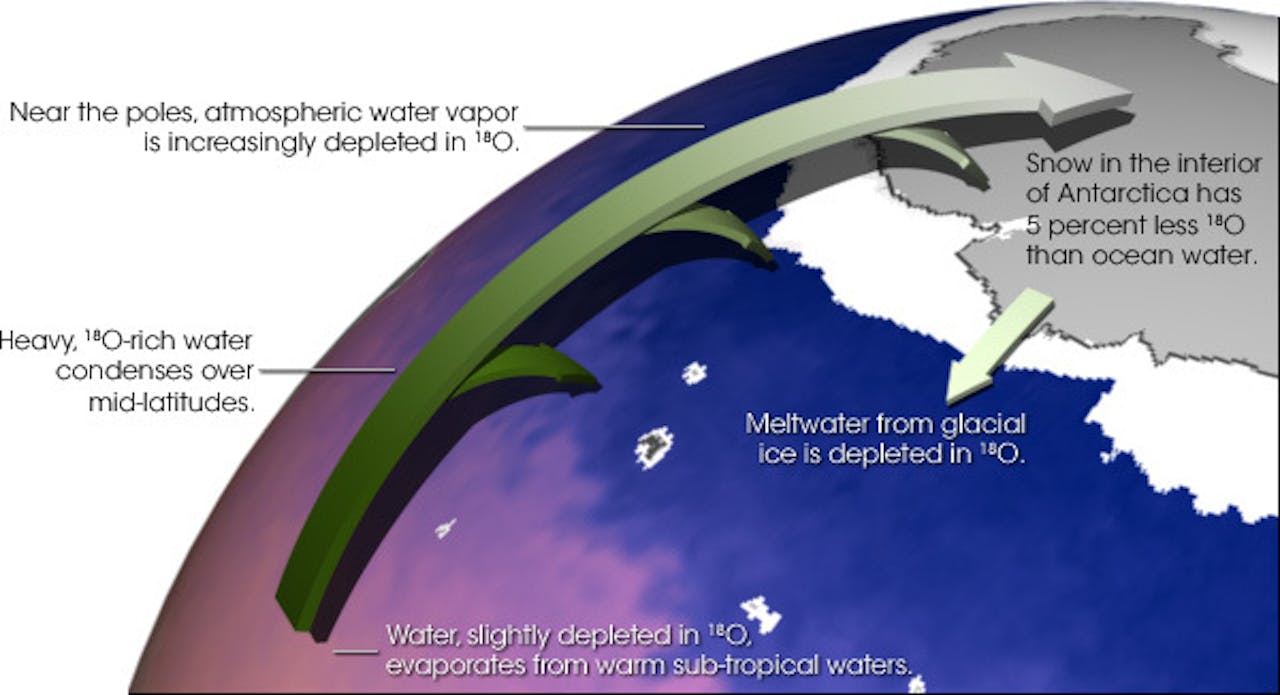
De zware watermoleculen in de tropen zijn meestal niet de D2O en HTO moleculen uit het begin van dit artikel. Er is namelijk nog een derde soort ‘zwaar water’, die nog veel meer voorkomt. Dat is water met een O-18 atoom erin. Dat O-18 atoom is niet radioactief, en valt dus niet op. Behalve in de massaspectrograaf van de isotopenchemicus.
NASADe atmosfeer is eigenlijk één grote destillatiekolom. Zware watermoleculen condenseren gemakkelijk als regen in de tropen, en lichte watermoleculen blijven langer zweven en worden pas regen in noordelijker streken zoals Nederland. Als je de molecuulmassa van regenwater nauwkeurig meet, kun je dus zeggen op welke breedtegraad de regen is gevallen. “Niet alleen het regenwater, maar eigenlijk al het (zoete) water van meren en rivieren verraadt zo zijn herkomst”, aldus Beets.