Het DNA van je baby uitlezen om genetische aandoeningen zo vroeg mogelijk op te sporen. In sommige landen nog experimenteel, terwijl het Verenigd Koninkrijk dat al vanaf 2030 standaard wil invoeren. Maar wil je wel alles weten over je kind?
Londen, 2030. In een kinderkamer ligt een pasgeboren meisje onder een dekentje te slapen. Haar moeder haalt haar voorzichtig uit het bedje en houdt haar tegen zich aan, terwijl een verpleegkundige een paar druppels bloed uit haar hiel prikt, een routinehandeling die in Nederland al decennia bekendstaat als de hielprik.
Maar hier in Londen voeren ze met dit bloed geen biochemische testen uit, zoals in Nederland. Nee, ze lezen haar héle DNA af en controleren die op honderden genetische afwijkingen. Vinden artsen een genetisch defect, dan kunnen ze direct een behandeling starten. Maar wat is eigenlijk verantwoord om te testen, te weten, en te melden als we het complete DNA van baby’s zouden uitlezen (sequencen)? Daar richt het tweede deel van dit drieluik zich op.
Gezondheidswinst
Dat ingewikkelde vraagstuk begint al in het laboratorium. Nadat de ruim 3 miljard bouwstenen van het menselijke genoom zijn uitgedrukt in letters, kammen experts door die berg aan informatie, op zoek naar afwijkingen. Niet in het wilde weg; ze zoeken naar specifieke afwijkingen. Maar welke? Dat is het eerste perikel.
Over die zaken is – tot op zekere hoogte – al eerder nagedacht. Namelijk bij de hielprik, het landelijk screeningsprogramma dat pasgeborenen test op 27 erfelijke aandoeningen. De selectie van die aandoeningen is enerzijds gebaseerd op de technische testmogelijkheden en anderzijds op de gezondheidsvoordelen voor het kind.
Neem de stofwisselingsziekte fenylketonurie (PKU). “De biochemische test voor die aandoening was de start van de hielprik in 1974”, vertelt professor Mirjam Langeveld, hoogleraar erfelijke metabole ziekten (Amsterdam UMC). Die stofwisselingsziekte veroorzaakt een ontwikkelingsachterstand en ernstige neurologische problemen. “Een behandeling binnen tien dagen na de geboorte verandert de levensloop van zo’n patiëntje significant: van een zwaar gehandicapt leven, naar een vrijwel normaal functionerend lichaam. Het levert dus enorme gezondheidswinst op.”
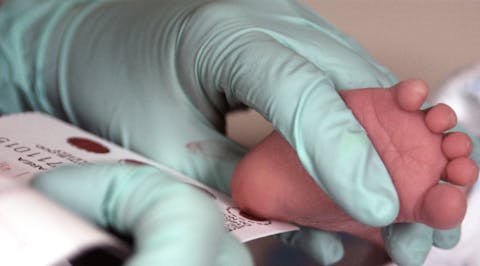
De hielprik, ingevoerd in Nederland in 1974, is het landelijk screeningsprogramma dat pasgeborenen test op 27 erfelijke aandoeningen. De selectie van die aandoeningen is enerzijds gebaseerd op de technische testmogelijkheden en anderzijds op de gezondheidsvoordelen voor het kind.
U.S. Air Force photo/Staff Sgt Eric T. Sheler, vrijgegeven in het publieke domein via Wikimedia Commons.De gezondheidszorg kan DNA-sequencing in de toekomst op verschillende manieren gebruiken. Eén scenario is dat DNA-sequencing wordt toegevoegd aan de bestaande hielprik. Het principe verandert dan niet: alleen screenen op ernstige ziekten die al vroeg in het leven sympromen geven én waarvoor een behandeling bestaat.
Het verschil is dat sequencing ook aandoeningen opspoort waar binnen de hielprik geen test voor bestaat, zoals cystinose, een zeldzame ziekte waarbij aminozuren zich in het lichaam ophopen. “Op die manier helpt het screenen van DNA het huidige doel van de hielprik beter te bereiken”, zegt Guido de Wert, biomedisch ethicus aan de Universiteit Maastricht. “Ethisch gezien levert dat weinig problemen op.”
Onbehandelbaar
Maar er is ook een ander scenario: dat sequencen een bredere toepassing krijgt door de data uitgebreider te analyseren. Zo kunnen artsen bijvoorbeeld allerlei extra aandoeningen opsporen die niet (goed) behandelbaar zijn, maar waarbij vroege detectie wél voordelen heeft.
“Uit vragenlijsten blijkt dat ongeveer zes van de tien ouders willen weten of hun kindje een onbehandelbare aandoening heeft”, vertelt Lidewij Henneman, hoogleraar patiëntenperspectief op genetica aan Amsterdam UMC. Vroeg of laat merken ouders toch dat er iets mis is met hun kind. “Wat vaak volgt, is een lange, frustrerende zoektocht met medische testen en doorverwijzingen.” Screen je bij de geboorte wel al op onbehandelbare aandoeningen, blijven ouders, de patiënt én ziekenhuizen dus een hoop medische testen – en kosten – bespaard.
Tegelijkertijd brengt DNA-sequencen ook weer nieuwe testen met zich mee. Wanneer de genetische test een afwijking bij een baby vindt, betekent het dat een dergelijke aandoening in de familie zit. Daarom zullen mogelijk ook de ouders, broertjes, zusjes en soms andere familieleden getest worden. Als ze dat zelf willen, tenminste.
In 2020 boog de Gezondheidsraad zich over de vraag of screening op onbehandelbare aandoeningen zinvol is. De raad oordeelde toen dat er geen principieel bezwaar bestaat, maar dat harde bewijzen voor de voordelen nog ontbreken. De Wert sluit zich aan bij dat oordeel: “Tijdige informatie helpt ouders zich voor te bereiden op het leven met een kind met een ernstige aandoening én om weloverwogen keuzes te maken over een volgende zwangerschap.”
Heeft een kind een genetische aandoening, dan hebben ouders bij een nieuwe kinderwens kans om opnieuw een kind te krijgen met die aandoening. “Ouders kunnen dan bijvoorbeeld kiezen voor embryoselectie of besluiten geen zwangerschap aan te gaan”, zegt Henneman.
In wiens belang?
Daarmee komt een nieuw ethisch dilemma in beeld. Hier gebruiken ouders de genetische informatie van het ene kind om het volgende te beschermen. In hoeverre mag dat? Ook daar hebben we in Nederland al over nagedacht, bijvoorbeeld in het geval van adrenoleukodystrofie (ALD) waar de hielprik sinds 2023 op test. De mutatie die ALD veroorzaakt, komt zowel bij mannen als vrouwen voor, maar bij vrouwen ontwikkelen de klachten meestal pas tussen hun veertigste en vijftigste levensjaar.
In theorie zou je een pasgeboren meisje kunnen testen, zodat ouders weten of een volgend zoontje risico loopt. Ook levert het informatie op voor het meisje, indien ze later zelf kinderen wil. Toch doen we dat in Nederland niet. “We screenen alleen in het belang van het kind zelf”, benadrukt Langeveld. “We testen geen meisjes met het oog op toekomstig moederschap, of om gezonde jongens te krijgen.”
Nog een openstaande vraag is tot waar in het DNA-boek van een kind ouders mogen meelezen. In Nederland geldt dat iemand vanaf de zestiende verjaardag zelf beslist over medische gegevens en behandelingen. Wettelijk gezien zouden ouders dus geen inzage mogen hebben in het genetisch paspoort dat aandoeningen omschrijft die vanaf die leeftijd ontwikkelen, tenzij het kind nadrukkelijk toestemming geeft.
— Guido de Wert
Ook het huidige hielprikscreeningsprogramma maakt onderscheid tussen ziekten die zich in de kinderleeftijd openbaren en aandoeningen die pas later ontwikkelen. De hielprik test alleen op aandoeningen die vroeg in het leven klachten geven én waarbij tijdige behandeling het verschil maakt. De keuze om informatie te krijgen over gezondheidsrisico’s later in het leven moet bij het kind zelf liggen, vindt ethicus De Wert. “Een kind heeft recht op ‘informationele zelfbeschikking’: het moet zelf kunnen kiezen of het dat soort kennis wil verkrijgen.”
Onnodige zorgen
DNA-sequencen biedt kansen, maar de techniek voor analyse bij gezond ogende pasgeborenen is niet perfect. Een hoop aandoeningen ontstaan door een ingewikkeld samenspel van genen, waardoor het ziektebeloop zich lastig laat voorspellen. Dat is bijvoorbeeld het geval bij de stofwisselingsziekte CPT2-deficiëntie. Daar leidt dezelfde combinatie van DNA-foutjes bij het ene kind al in de eerste levensjaren tot spierafbraak, bij een ander pas in de puberteit, en soms zelfs pas op hoge leeftijd.
Zo’n grote spreiding maakt het moeilijk om duidelijke voorspellingen te doen. Als artsen zulke risico’s tóch melden, veroorzaakt dat mogelijk onnodige onrust. Ook na een vals alarm bij de hielprik blijven ouders soms jarenlang twijfelen aan de gezondheid van hun kind, en bezoeken daardoor vaker de huisarts. “Ouders onthouden vooral de boodschap dat er iets mis is met hun kind”, aldus Langeveld.
Het genoom van een baby is een gigantisch boekwerk. Je zou zeggen: hoe meer we eruit lezen, hoe beter. Maar zo simpel is het niet. De Wert: “De vraag is niet óf DNA-sequencing voordelen heeft, maar of en wanneer voordelen van een brede analyse opwegen tegen nadelen – zowel voor de familie als op de werkvloer van ziekenhuizen.” Want meer testen betekent ook meer werk voor laboratoria en artsen, in een zorgsysteem dat al kampt met krapte. Daarnaast zijn behandelingen voor zeldzame ziekten vaak extreem duur. “We moeten ons afvragen of we dat als samenleving kunnen en willen dragen”, aldus De Wert.
Je kindje in kaart
Het DNA van je baby laten uitlezen om genetische aandoeningen zo vroeg mogelijk op te sporen en te behandelen. In sommige landen nog experimenteel, terwijl het Verenigd Koninkrijk al vanaf 2030 zo’n genetische screening standaard wil invoeren. De belofte is groot: wie wil zijn kind nu niet de beste start geven? Maar is het wel zo simpel?

