Onderzoekers van onder andere het AMOLF-instituut in Amsterdam zijn er voor het eerst in geslaagd de waarschijnlijkheidsverdeling van een elektron in een waterstofatoom zichtbaar te maken. Die verdeling laat zien waar de kans het grootst is om een elektron tegen te komen in het atoom.
Hoewel een elektron soms als een deeltje beschouwd kan worden, laat het in experimenten vaak een golfkarakter zien. Zo ook in het experiment dat Aneta Stodolna, promovendus van het Instituut voor Atoom- en Molecuulfysica (AMOLF) in Amsterdam, samen met collega’s uitvoerde. Met een in Amsterdam ontwikkelde microscoop brachten zij en collega’s voor het eerst het waterstofatoom (dat bestaat uit een proton en een elektron) in kaart met een ongekende precisie.
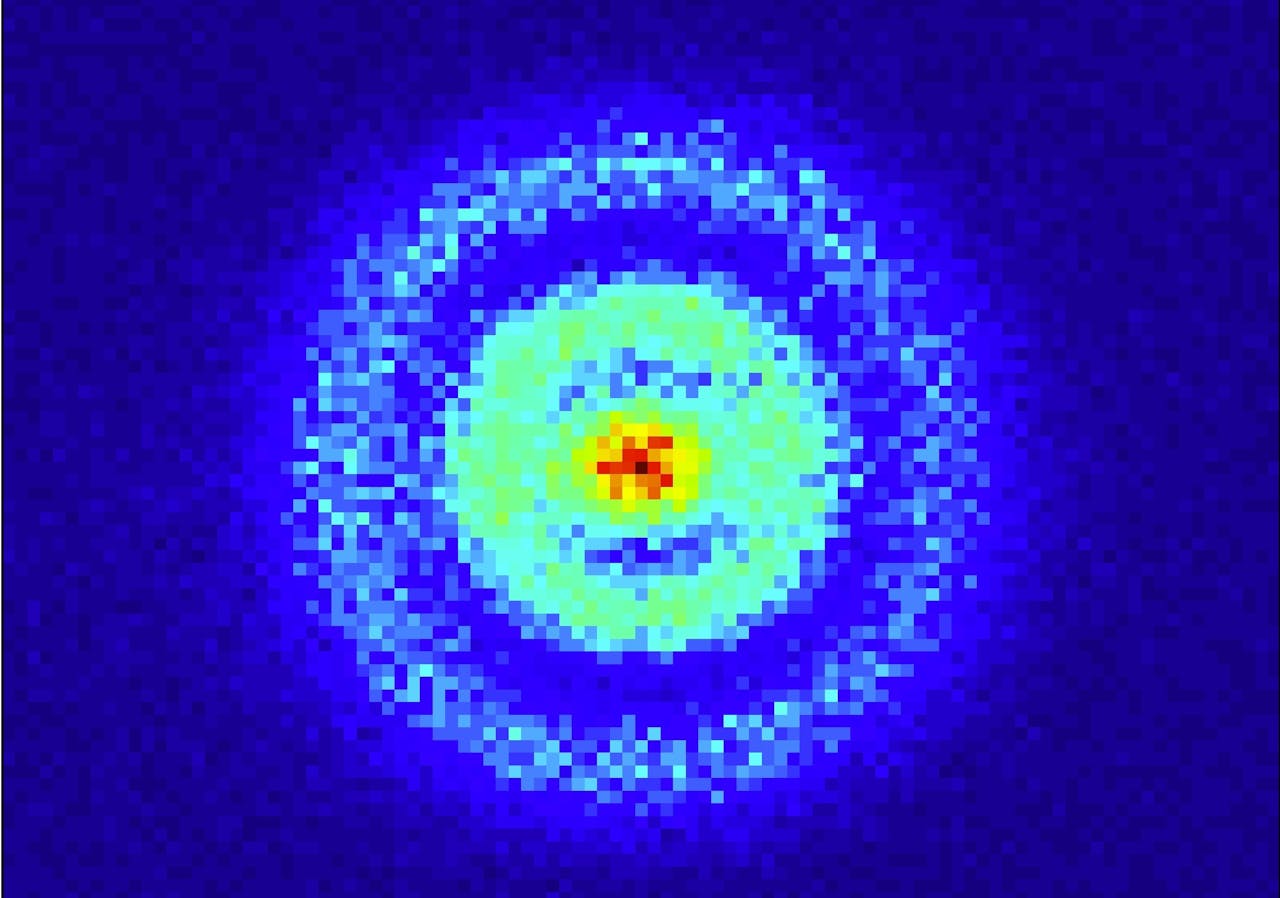
Een waarschijnlijkheidsverdeling van een elektron in een waterstofatoom.
AMOLF/Aneta StodolnaHet bovenstaande plaatje is het resultaat. Het laat in lichtblauw de plekken in het atoom zien waar de kans het grootste is het elektron tegen te komen. Die kans blijkt het grootst te zijn in het midden, bij de roodgele punt. Dat is vlakbij de atoomkern ofwel het proton (die overigens zo klein is dat hij niet te zien zou zijn op deze schaal). Daaromheen zit een relatief groot gebied waar het elektron met regelmaat gevonden wordt. Dan is er een zone waar de vindkans tot nul zakt, om vervolgens in een ringvormig gebied weer groter te worden. Deze zone’s zijn te vergelijken met een golf waarin buiken en knopen zitten, en die bovendien door de quantummechanica worden voorspeld.
50.000 metingen
Stodolna en collega’s kregen dit bijzondere kijkje in het atoom voor elkaar door waterstofatomen in een ruimte met een elektrisch veld te leiden. Ze werden vervolgens met een korte en krachtige laserpuls bestookt. De puls zorgt ervoor dat het elektron in het atoom geëxciteerd raakt, oftewel een hoger energieniveau krijgt.
Normaalgesproken zou een elektron na verloop van tijd weer terugvallen naar een lager energieniveau, maar het aanwezige elektrische veld zorgt ervoor dat het elektron het atoom makkelijk kan verlaten. “Eigenlijk boren we met het elektrische veld een gat in het potentiaal van het atoom waardoor het elektron kan ontsnappen”, laat Stodolna weten.
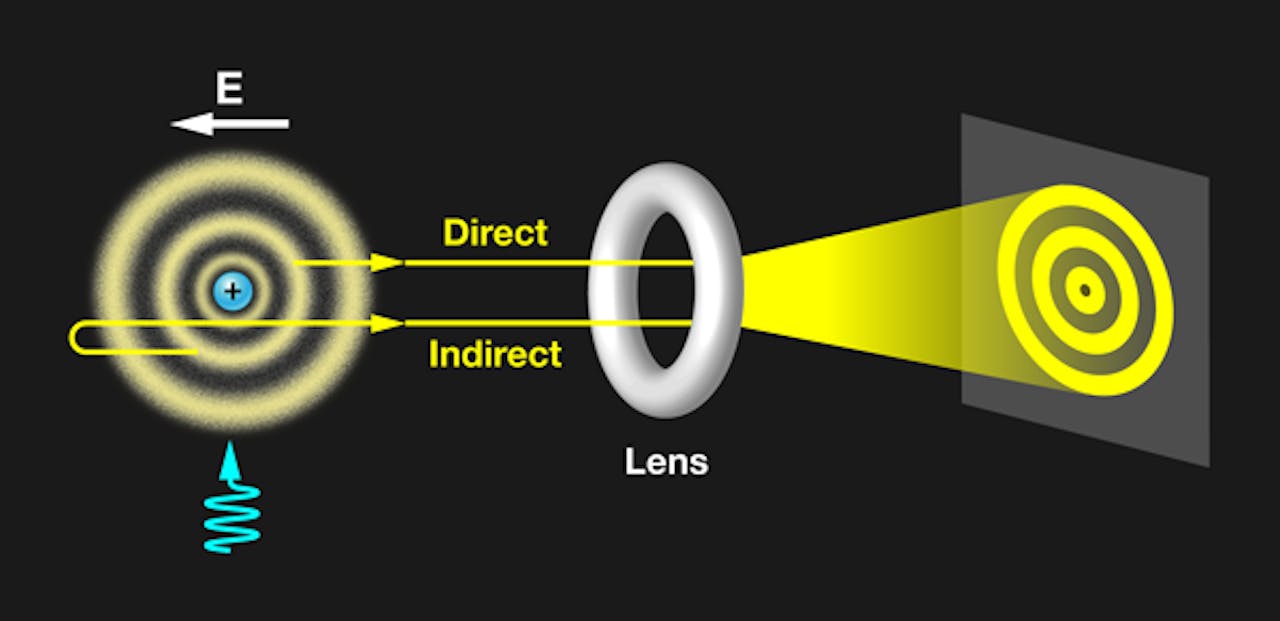
Met deze opstelling zijn de orbitalen van een elektron in waterstof zichtbaar gemaakt. Door met een laser op het atoom (links) te schijnen wordt het aanwezige elektron geëxciteerd en uiteindelijk los gemaakt. Het valt dan door een lens op een scherm (rechts) waar het wordt gedetecteerd. Zo kan worden afgeleid waar het elektron zich bevond op het moment dat het het atoom verliet.
APS/Alan StonebrakerHet vrijgemaakte elektron wordt vervolgens door het elektrische veld via een vergrotende lens naar een detectorscherm geleid. Uit de meting van de detector kan worden afgeleid waar het elektron zich bevond op het moment dat hij het atoom verliet. Door deze meting veelvuldig te herhalen kan uiteindelijk een beeld worden gevormd van de posities in het atoom waar het elektron vaak gevonden is.
“Voor het maken van zo’n beeld hebben we wel 50.000 metingen gedaan. Maar omdat we er 10 per seconde konden doen, waren we toch binnen afzienbare tijd klaar. De laserpuls die het elektron exciteert duurt slechts 7 nanoseconden”, zegt Stodolna.
Clues voor helium
Het zichtbaar maken van orbitalen in atomen is lastig en tot nu toe nog nauwelijks gedaan, laat Stodolna weten. Wel is het met lasers eerder al mogelijk geweest om dergelijke verdelingen in moleculen in beeld te brengen. “Waterstof is een eigenlijk een lastig atoom om te onderzoeken, want het is instabiel en het heeft een vrij hoge ionisatiepotentiaal”, zegt ze. “Het komt normaal gesproken voor als het veel stabielere diwaterstof. Wij hebben losse waterstofatomen verkregen door ze met een sterke laser vrij te maken uit H2S.”
De resultaten bevestigen theoretische voorspellingen, zo schrijven de onderzoekers in hun artikel, en zijn nuttig voor vervolgonderzoek. “Dit is zeer bruikbaar voor vergelijkbare metingen die we ook aan het iets zwaardere helium-atoom hebben gedaan. Dat is wetenschappelijk gezien eigenlijk iets interessanter omdat daar niet een maar twee elektronen in zitten. We kunnen hopelijk met deze methode onderzoeken welke interacties deze elektronenen met elkaar hebben”, laat Stodolna weten.

Stodolna en collega’s waren in staat verschillende verdelingen van het elektron waar te nemen. Deze werden zichtbaar door de elektronen in het atoom met verschillende energieën aan te slaan.
AMOLF/Aneta StodolnaStodolna besluit: “Die helium-experimenten hebben we twee jaar geleden eigenlijk al gedaan, maar we waren nog goed niet in staat de resultaten te interpreteren. Dat lukt nu al veel beter. Het volgende artikel, over deze experimenten met helium, staat al in de steigers.”

