In de hersenen van Alzheimer-patiënten plakken eiwitfragmenten aan elkaar tot lange amyloïd draden. Die draden kunnen rond zijn, of plat als een lint. Amerikaanse onderzoekers publiceerden in Nature Materials een model dat de vorm van eiwitdraden voorspelt. Dit kan helpen om beter te begrijpen hoe die plakkende eiwitten ontstaan.
Eiwitten en eiwitfragmenten kunnen om allerlei redenen aan elkaar gaan ‘plakken’. Soms levert dat ongestructureerde klonten of plaques op, maar ook keurige lange draden zijn mogelijk. Een goed voorbeeld van dat laatste zijn de collageenvezels die het hoofdbestanddeel vormen van onze huid. Deze vezels bestaan uit drie lange collageenstrengen die om elkaar heen draaien en zo een keurige, maar ook heel sterke drievoudige helix vormen. Zo’n helix kan weer plakken aan andere helices en samen levert dat stevige vezels op.
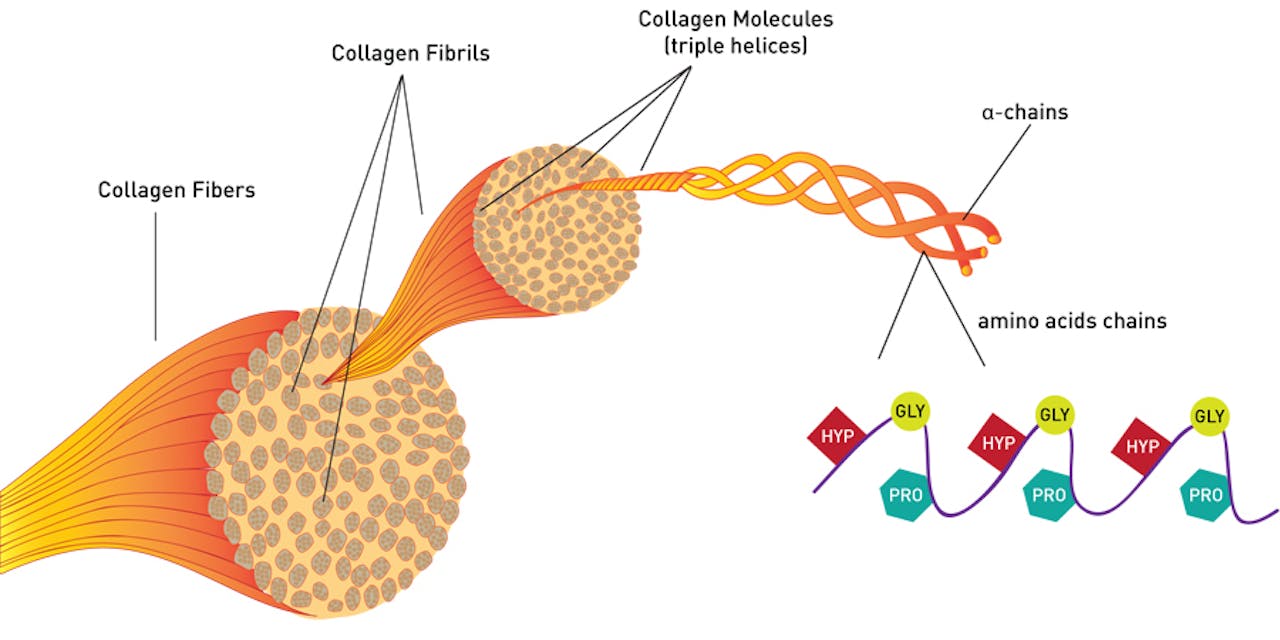
Een collageenvezel bestaat uit heel veel collageenfibrillen, wat weer bundels zijn van meerdere collageenhelices. Ieder helix bestaat uit drie collageenstrengen. Rechtsonderzoek de aminozuren waaruit het meest voorkomende collageen is opgebouwd. Gly = glycine, Pro = proline, Hyp = hydroxyproline.
Wikimedia CommonsZonder de vezelvorming van collageen zouden onze huid, maar ook allerlei andere weefsels zoals pezen, kraakbeen en botten volledig structuurloos zijn. Toch zijn het allemaal heel verschillende weefsels met heel andere eigenschappen en functies. Ook het hoornvlies in ons oog – dun en transparant – is uit collageen opgebouwd. Nou heeft ons lichaam meerdere typen collageen, maar die lijken onderling heel sterk op elkaar. Hoe kunnen al die verschillende weefsels ontstaan uit vrijwel gelijke bouwstenen? Die vraag houdt polymeerchemicus Greg Grason van de Universiteit van Massachussetts in Amherst (Verenigde Staten) al een tijd bezig. De dikte van de uiteindelijke collageenvezel speelt een grote rol. Hoe meer collageenbundels aan elkaar plakken, des te stugger de vezel. Maar welke factoren bepalen de dikte van die vezel? En wanneer en waardoor stopt de samenklontering?
Microscopische opname van oogweefsel met daarin duidelijk zichtbaar lange amyloïd vezels. Ook bij de oogziekte glaucoom spelen deze vezels een kwalijke rol.
Georgia Institute of Technology via EurekAlert.orgKabel of lint?
Grason werd op een nieuw spoor gezet door een vraag van een collega over de vorm van amyloïd-draden. Dit zijn lange draden van samenklonterende eiwitfragmenten die zich vormen in de hersenen van patiënten met Alzheimer, Parkinson en Huntington. De amyloïd-draden vormen net als collageen gedraaide bundels die samen dikkere vezels vormen. Maar soms zien ze eruit als een ronde kabel en in andere gevallen als een plat lint. De vraag aan Garson was hoe dat verschil tussen kabel of lint ontstaat, want de bouwstenen zijn grotendeels gelijk.
“Dit bracht ons op het idee om een model te ontwikkelen voor de zelfassemblage van draden tot vezels en op die manier uit te zoeken welke factoren bepalen hoe de vezel groeit”, legt Grason uit per e-mail. “De vorming van vezels uit helixvormige strengen is een veelvoorkomend motief in biologische structuren. Maar ook in supramoleculaire polymeren en organogels zien we helices die samen weer grotere structuren vormen. Wij zijn geïnteresseerd in de algemene principes achter de vorming van deze vezels. Wat bepaalt of de draden op een gelijkmatige manier om elkaar heen draaien en een ronde kabel vormen of dat ze meer aan een kant plakken waardoor een meer rechthoekig groeivlak ontstaat? Want dan krijg je een plat lint.”
Spanning in de vezel
Uit eerder onderzoek wisten Grason en collega’s al dat de draaiing in de bundels op een gegeven moment de pakking van de losse strengen moeilijker maakt. Niet alle chemische groepen in de strengen willen bij elkaar in de buurt zitten en dat leidt tot een draaiing als de strengen samen een bundeltje vormen. Hoe meer strengen bij elkaar klonteren, des te minder ruimte er is voor iedere chemische groep om een goed plekje te vinden en hoe meer spanning er ontstaat. Al modellerend bleek snel dat het aantal strengen een belangrijke factor is voor de uiteindelijke vorm van de vezel. Eerst groeit de vezel op een uniforme manier – de vezel wordt in alle richtingen gelijkmatig ‘dikker’. Maar door de draaiing wordt de ruimte voor nieuwe strengen aan de buitenkant beperkter en ze gaan elkaar in de weg zitten. Vanaf dat moment groeit de vezel niet meer gelijkmatig en ontstaat een plattere structuur.

De twee vormen van amyloïd vezels; rond en plat. Van beide de gesimuleerde vorm met daarnaast een microscopische opname van de daadwerkelijke vezel. Greg Grason en collega’s zijn er voor het eerst in geslaagd aan te tonen welke factoren de uiteindelijke vorm van de vezel bepalen.
UMass Amherst/Greg Grason via EurekAlert.orgHet model werd getest door voorspellingen te doen over de uiteindelijke dikte en vorm van amyloïd vezels op basis van het aantal strengen en de moleculaire eigenschappen van de strengen. De voorspellingen kwamen uit. Experimenteel gegroeide amyloïd vezels bleken zich precies zo te vormen als de onderzoekers op basis van hun model hadden berekend. Een zeldzame voldoening, aldus Grason. “Het gebeurt niet vaak dat je begint met complexe waarnemingen, daar een model voor maakt, dat gebruikt voor simulaties die je vervolgens meteen experimenteel bevestigt ziet.”
Gevraagd naar wat dit resultaat betekent voor het onderzoek naar de schadelijke amyloïd-vezels, laat Grason weten dat ze daar niet direct aan hebben gewerkt. “Maar ik zie wel mogelijkheden om ons model te gebruiken om nieuwe inzichten te krijgen over hoe amyloïd-vezels precies ontstaan en verder groeien. Dit model en de experimentele toetsing die we hebben opgezet kan helpen om de rol van verschillende factoren in kaart brengen. Bijvoorbeeld de invloed van specifieke aminozuurvolgorde. Als je beter weet wat er precies gebeurt in de stap van losse fragmenten naar kleine bundels en tot slot naar grote vezelstructuren, vind je wellicht ook nieuwe aanknopingspunten om ergens in dat proces in te grijpen.”

