Onderzoekers bouwden een extra gen in op een gerichte plek in het DNA. Dit gebeurde voor het eerst in het menselijk lichaam. Patiënten met een stofwisselingsziekte kregen het extra gen toegediend. Hiermee kan hun lichaam hopelijk zelf een enzym aanmaken waarvoor ze dan niet meer wekelijks aan het infuus hoeven.
In het voorjaar van 2018 kregen vier patiënten met het syndroom van Hunter het gen toegediend dat voor het enzym zorgt die zij sinds hun geboorte missen. Dit enzym, iduronaat-2-sulfatase (IDS), is nodig om bepaalde suikers af te breken. Bij patiënten met de stofwisselingsziekte hopen deze suikers op in de cellen wat leidt tot luchtwegproblemen, hartafwijkingen, gewrichtsproblemen, doofheid en verstandelijke beperkingen. Het Amerikaanse bedrijf Sangamo Therapeutics presenteerde 5 september de eerste resultaten.
Voor het eerst in de mens
Het gen, verpakt in een virus, komt via een injectie in de bloedbaan uiteindelijk in de lever. De levercellen, die normaal het enzym maken, nemen het gen vervolgens op in hun DNA. Dat dit direct in het lichaam gebeurt is voor het eerst. Het virus levert, behalve het gen, ook een middel om het DNA op een gerichte plek open te knippen: een zogeheten zinkvingernuclease. Een zinkvinger herkent een specifieke plek in het DNA die de onderzoekers vooraf selecteren. Aan de zinkvinger is een nuclease gekoppeld dat de DNA-streng openknipt. Het natuurlijke mechanisme van de cel wil deze breuk repareren. Op het moment dat er een extra gen in de buurt is, is de kans groot dat dit gen in de breuk terechtkomt. De levercellen repareren dus het opengeknipte DNA en bouwen hierbij het nieuwe gen voor het missende enzym (IDS) in. Of dat ook alleen precies op deze gewenste locatie gebeurt moet nog blijken.
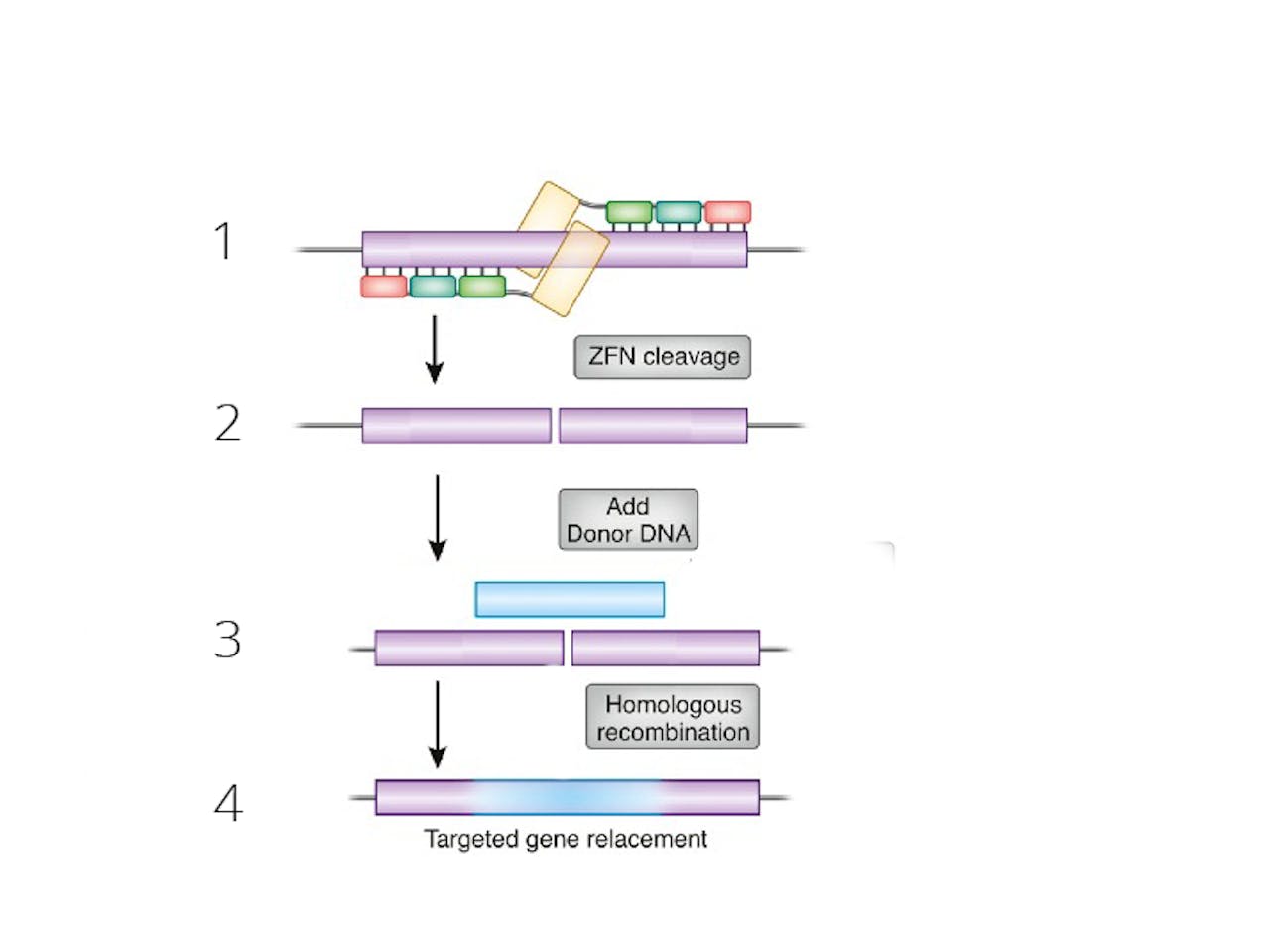
Het genoom aanpassen met zinkvingernucleases. Drie zinkvingers binden aan een specifiek deel van het DNA (1). Een nuclease knip op deze plek het DNA open (2). Een extra gen wordt toegevoegd (3) en op de plek van de breuk in het DNA gezet (4).
Dana Carroll via Wikimedia Commons, bewerking door NEMO KennislinkHet gen zit dus verweven in het genoom van de patiënt. Dat heeft als voordeel dat deze therapie maar één keer nodig is. Elke keer als de levercellen zich delen maken ze een kopie van het IDS-gen. Dat scheelt wekelijkse ziekenhuisbezoeken waarbij de patiënten IDS via een infuus aangevuld krijgen.
De zinkvingertechniek maakt het dus mogelijk om een specifieke locatie in het DNA te kiezen en het DNA hier open te knippen. Dit lijkt op de nieuwere CRISPR-Cas-techniek, die op een specifieke plek eigenschappen aan het DNA kan toevoegen. Sangamo houdt zich met name bezig met de al langer bekende zinkvingers, en dat lijkt wat op te leveren. “Er zijn maar een paar labs die genoeg expertise hebben om zinkvingers op een gerichte plek te laten knippen. Deze trial is een grote stap voorwaarts, omdat dit de eerste keer is dat zinkvingers het DNA van mensen aanpassen ín het lichaam”, zegt Marianne Rots, die zelf al lang onderzoek doet met zinkvingers bij het UMCG.
Los in de celkern
Twee vergelijkbare gentherapieën werden al eerder ingezet bij mensen. In de eerste haalden onderzoekers, wederom van Sangamo, cellen uit het lichaam van een patiënt. Vervolgens behandelden zij ze met zinkvingernucleases om het DNA aan te passen, net als hierboven beschreven. Tot slot plaatsten zij de cellen weer terug in de patiënt. Het verschil is dus dat in de nieuwste trial van Sangamo de levercellen het lichaam van de patiënt niet hoeven te verlaten om de DNA-verandering te ondergaan. Dit is minder belastend voor de patiënt en efficiënter.
Een tweede vergelijkbare therapie is het toevoegen van het nieuwe gen in de celkern, zonder deze in te bouwen in de DNA-streng. Doordat het nieuwe gen zich wel in de celkern bevindt, levert dit een gezond enzym op. Het verschil is dat deze aanpassing niet blijvend is, het nieuwe gen wordt niet gekopieerd voor de nieuwe cellen. Mocht het nieuwe DNA schadelijke gevolgen hebben, dan kun je er dus ook weer vanaf komen.
Maar het heeft ook nadelen. Piter Bosma van het AMC, die zelf een gentherapie ontwikkelt voor geelzucht, licht dat toe: “Wil je DNA in snel delende cellen aanpassen, zoals het beenmerg, dan kun je het nieuwe gen beter laten opgaan in het genoom. Na de celdeling is de correctie dan nog steeds aanwezig. Als je dat op een willekeurige plek inbouwt is er klein risico dat dat vervelende bijwerkingen als leukemie veroorzaakt.”
Veiliger
In dit nieuwe onderzoek is een zinkvinger toegevoegd die het DNA op een plek openknipt die veilig is en geen tumorgen aanzet. “De kans is groot dat het gen die open plek opvult, maar honderd procent specifiek is het nog steeds niet en dit is in het lichaam moeilijk te achterhalen”, zegt Bosma. Overigens is het volgens Bosma bij de lever niet nodig dat het gen opgaat in het DNA: “Levercellen delen namelijk niet zoveel meer bij volwassenen, maar deze studie kan wel een bewijs leveren dat dit in het menselijk lichaam mogelijk is.”
In het onderzoek van Sangamo zijn nog geen negatieve bijwerkingen zoals kanker gesignaleerd, maar daar is het na vier maanden ook nog wat vroeg voor. Of de proefpersonen daadwerkelijk IDS kunnen aanmaken is nog niet gemeten. “Het kan zijn dat het nieuwe gen maar enkele levercellen heeft bereikt”, denkt Bosma. Voor de veiligheid krijgen de patiënten nog extra IDS via het infuus, maar dat maakt het lastig om te bepalen of er IDS uit de levercellen komt. Gevoeligere meetapparatuur en een hogere dosis moeten binnenkort duidelijk maken of de lever weer in staat is IDS te maken.