Dat het immuunsysteem uit allerlei verschillende celtypen bestaat is geen nieuws. Maar de variatie is nog veel groter dan gedacht, concluderen Leidse onderzoekers in het tijdschrift Immunity. Ze hopen nu meer grip te krijgen op de grote verschillen tussen patiënten met dezelfde ziekte.
Ons immuunsysteem is een bonte verzameling van cellen met verschillende functies. Er zijn bijvoorbeeld cellen die ziekmakende indringers herkennen, ‘killercellen’ die tumoren doden, cellen die antistoffen maken en cellen die alle rommel opruimen. En dit is nog maar een kleine greep uit het complete assortiment immuuncellen, waarvan er miljoenen overal in ons lichaam actief zijn.
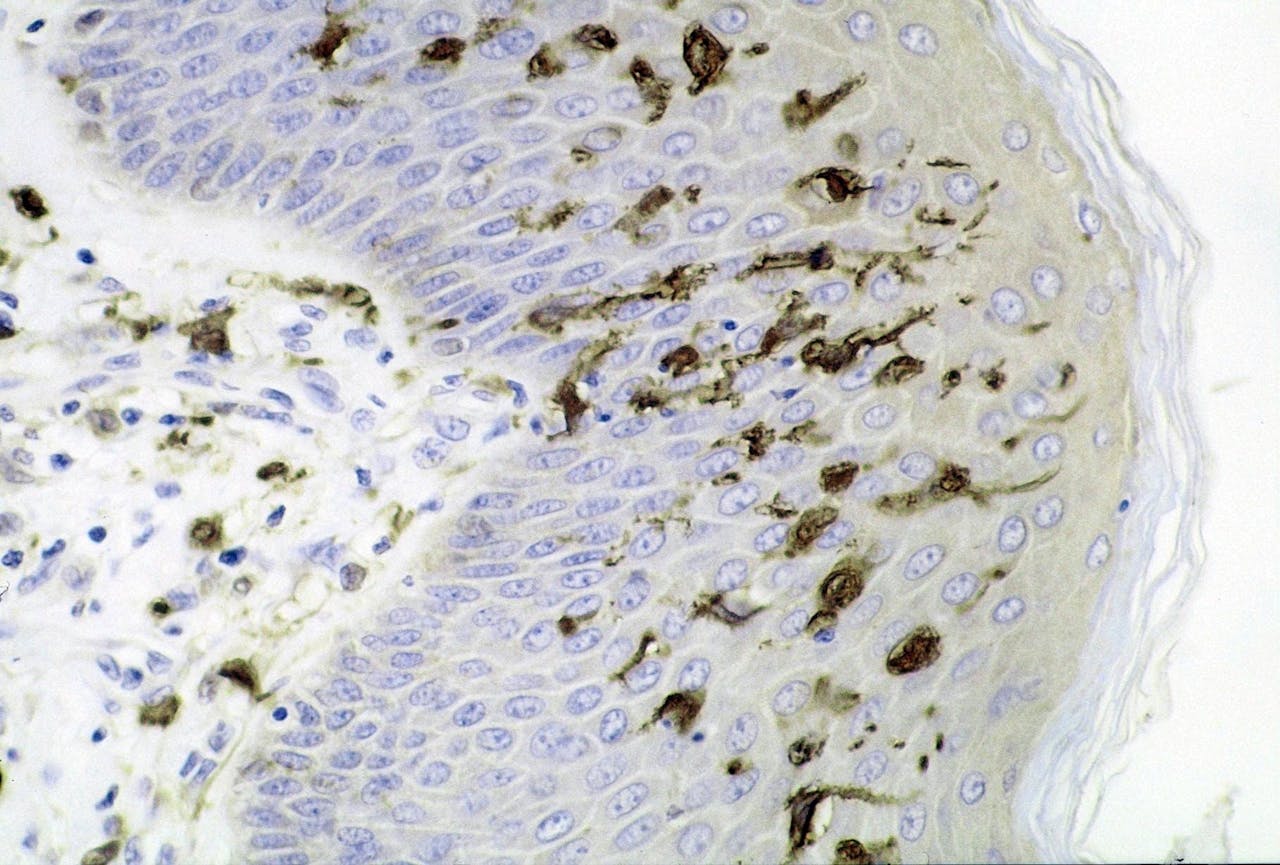
Doorsnede van de epidermis, de buitenste laag van de huid. De donkere vlekjes zijn dendritische cellen, cellen die ziekmakende indringers herkennen.
Haymanj via Wikimedia Commons, publiek domeinOp basis van hun functie worden de immuuncellen onderverdeeld in hoofdgroepen, zoals dendritische cellen (‘herkenners’), T-cellen (‘killercellen’), B-cellen (‘producenten van antistoffen’) en macrofagen (‘vuilnismannen’).
“En binnen die hoofdgroepen onderscheiden we weer allemaal subgroepen”, zegt Frits Koning, hoogleraar immunologie aan het Leids Universitair Medisch Centrum (LUMC). “Neem bijvoorbeeld de T-cellen, daar kennen we heel veel verschillende soorten van. Het verschil zit onder andere in de eiwitten aan de buitenkant van de T-cel. Die eiwitten bepalen aan welk soort cel de T-cel kan binden en dus kan doden. Maar daarmee zijn we er nog niet, want ook binnen een type T-cel zien we weer verschillen.”
Glutenintolerantie
Koning wil die verschillen in kaart brengen, omdat hij vermoedt dat we dan beter kunnen begrijpen hoe immuungerelateerde ziekten ontstaan en waarom we zulke grote verschillen zien tussen patiënten met dezelfde ziekte. Zijn onderzoeksgroep werkt aan immuunziekten in het darmstelsel, zoals coeliakie (‘glutenintolerantie’) en de ziekte van Crohn. Bij deze ziekten reageert het immuunsysteem ten onrechte op bepaalde stoffen of valt het lichaamseigen weefsel aan.
Bij coeliakie zorgt het eten van gluten, uit tarwe en andere granen, voor heftige ontstekingen in de dunne darm. Een levenslang, strikt glutenvrij dieet is de enige behandeling die we nu kennen. Bij patiënten met de ziekte van Crohn reageert het immuunsysteem in de dikke darm overdreven sterk op onschadelijke bacteriën. Ook hier leidt dat tot ernstige, vaak chronische ontstekingen. De behandeling bestaat uit ontstekingsremmende medicijnen, maar lang niet alle patiënten reageren daar even goed op.
“We weten dat bij coeliakie in ieder geval drie typen T-cellen zijn betrokken, waaronder CD4 T-cellen. Maar die spelen ook een belangrijke rol bij Crohn, terwijl het twee heel verschillende ziekten zijn die elk op een specifieke plaats in het darmstelsel voorkomen. Daarnaast zien we grote verschillen tussen patiënten. Sommige coeliakie-patiënten vertonen relatief milde symptomen, terwijl anderen zeer ernstige vormen ontwikkelen die zelfs kunnen overgaan in kanker. En een kwart van de Crohn-patiënten krijgt te maken dusdanig ernstige ontstekingen dat operaties nodig zijn om de schade te herstellen. Waarom krijgt de een een ernstige vorm en de ander niet? Dat willen we graag weten.”
Bloed en darmweefsel
Om meer details te ontrafelen over de verschillen tussen immuuncellen analyseerden Koning en zijn promovendus Vincent van Unen een set van bloedmonsters en stukjes darmweefsel. Hiervoor gebruikten ze een techniek die massa cytometrie wordt genoemd (zie kader onderaan). De monsters waren afkomstig van patiënten met verschillende stadia van coeliakie of Crohn en van een zogeheten controlegroep – mensen met darmklachten die een endoscopie (inwendig darmonderzoek) moesten ondergaan waaruit bleek dat er geen darmontsteking te vinden was.
Alle bloed- en darmmonsters leverden samen een collectie van 5,2 miljoen immuuncellen. Van al die cellen bepaalde Van Unen welke van de geselecteerde antilichamen aan hun oppervlak waren gebonden en om hoeveel antilichamen het ging. Koning: “Hij is bijna negen maanden bezig geweest om de monsters te meten en daarna hadden we nog eens zes maanden nodig voor de analyse van die enorme set meetgegevens.”
Uit de zes hoofdgroepen waar ze mee begonnen (B-cellen, myeloïde cellen, innate lymfocyten en drie typen T-cellen) kwamen 142 subgroepen naar voren. Een subgroep omvat cellen die onderling sterk op elkaar lijken en die tegelijkertijd verschillen van alle andere cellen in deze set. “Dat zijn dus veel meer subgroepen dan we hadden verwacht”, aldus Koning. “We wisten dat er ook binnen celtypen variatie was, maar niet in deze mate.”
Verschillen tussen patiënten
Een van de meest opvallende resultaten is volgens Koning het sterke verschil tussen bloed en darmweefsel. “Zonder je dat vooraf weet met welk monster je te maken hebt, maakt deze techniek probleemloos onderscheid tussen immuuncellen uit bloed en uit darmweefsel. Dat vind ik een heel belangrijk resultaat, want het laat zien dat een bloedmonster zeer beperkt informatie geeft over wat er in het darmweefsel aan de hand is.”
Ook kan deze techniek scherp onderscheid maken tussen de verschillende groepen patiënten. “De immuuncellen uit het darmweefsel van coeliakie-patiënten vormden een duidelijk aparte groep, net als die van de Crohn-patiënten. Ook konden we de verschillende stadia en complicaties eenvoudig van elkaar onderscheiden. We gaan nog meer van deze studies doen en ik hoop dat het ons helpt om de verschillen tussen patiënten te verklaren, zodat we ook de behandeling veel gerichter op de individuele patiënt kunnen afstemmen.”