Implantaten worden nogal eens geplaagd door infecties of afstotingsreacties. Wetenschappers van de Universiteit Twente slaagden er in om bacteriën zo aan te passen dat ze aan een vast oppervlak hechten en kunnen dienen als een ‘levende lijm’ tussen het implantaat en de lichaamscellen.
Een bacterie houdt er niet van om vastgebonden te worden. Fixeer je haar bijvoorbeeld via een sterke covalente binding aan een oppervlak dan gaat het vaak mis. Óf de bacterie zorgt ervoor dat het stuk membraan waaraan zij vastzit wordt afgescheiden, óf zij sterft simpelweg.
Nu zijn bacteriën genetisch relatief makkelijk aan te passen. Het lukte wetenschappers van de Universiteit Twente om deze flexibiliteit te benutten en de darmbacterie Escherichia coli (E. coli) via een eenvoudige aanpassing te fixeren op een vast oppervlak. De fixatie lijkt op een natuurlijke binding die de bacterie normaal gesproken met haar soortgenoten aangaat.
De vinding kan van pas komen bij het voorkomen van afstotingsreacties en infecties rondom implantaten. De wetenschappers zeggen dat de bacteriën dienen als brug tussen bijvoorbeeld een stent, die wordt geplaatst om een bloedvat open te houden, en de cellen in de wand van het bloedvat. Het onderzoek is gepubliceerd in het wetenschappelijke tijdschrift ACS Nano.
Handboei
De binding bestaat aan de ene kant uit een eiwit dat door de bacterie zelf wordt gemaakt en in de celwand terechtkomt. Deze vormt een soort haak. Op het te binden vaste oppervlak (in dit onderzoek glas en goud) zit het aminozuur tryptofaan vast. Tryptofaan heeft een grote zijgroep, die essentieel is voor deze binding.
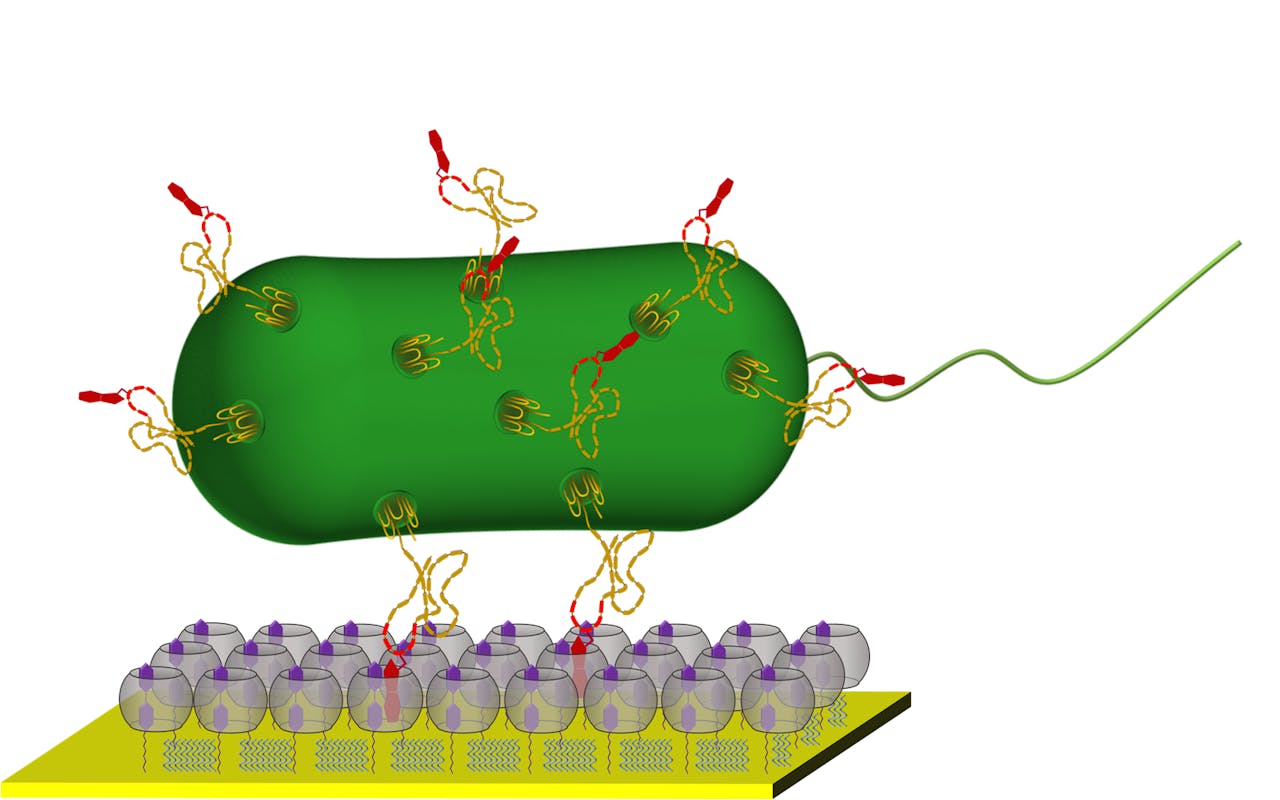
Een _E. coli_-bacterie is via eiwitten in haar celwand gebonden aan kunstmatige structuren op een vast oppervlak.
Sankaran et al. via ACS NanoEen zijgroep van het membraaneiwit van de E. coli gaat vervolgens samen met de zijgroep van het tryptofaan op het oppervlak in een ‘pompoenvormig’ hulpmolecuul zitten. De onderzoekers spreken van een handboei of musketonhaak. Dit hulpmolecuul bindt de twee haken aan elkaar, maar kan ze ook weer loslaten.
Flexibele ankers
Er is al veel onderzoek gedaan naar het fixeren van bacteriën op een vast oppervlak. “En veel onderzoekers gebruiken daarvoor covalente bindingen”, zegt Pascal Jonkheijm, professor Bioinspired Molecular Engineering van de Universiteit Twente en onderzoeksleider. “Dat werkt, maar op de middellange termijn ontstaan vaak problemen doordat de bacteriën hun natuurlijke beweeglijkheid verliezen.”
Jonkheijm legt uit dat de buitenkant van een cel, het membraan, erg flexibel is. Het is in beweging en ververst continu. Flexibele ankers, zoals degene die hij onderzoekt, werken in zo’n omgeving het best. “Je denkt misschien dat een binding die ook weer kan loslaten niet nuttig is, maar in ons geval zitten er misschien wel honderd van die flexibele ankers vast”, zegt Jonkheijm. “Uiteindelijk is de bacterie toch gefixeerd en bovendien kan zij nog steeds bewegen.”
Door bacteriën op deze flexibele manier aan bijvoorbeeld stents te binden, die worden gebruikt om bloedvaten open te houden, worden ze een brug tussen het harde oppervlak van het implantaat en de endotheelcellen die de wand van het bloedvat vormen.
“Eigenlijk proberen we de endotheelcellen in het lichaam voor de gek te houden”, zegt Jonkheijm. “Doordat we de _E. coli_-bacteriën bepaalde eiwitten meegeven, zien cellen in het lichaam ze aan voor andere lichaamseigen cellen. Daar gaan ze dan netjes een binding mee aan. Dit moet overigens nog getest worden in het lab.”
Energie opwekken
Maar als je de bacteriën kunt aanpassen om een binding te maken met een oppervlak, is het dan niet mogelijk om er voor te zorgen dat bijvoorbeeld de endotheelcellen van de bloedvaten dat zelf doen? “Dat is waarschijnlijk een stuk ingewikkelder”, zegt Jonkheijm. “Het grote voordeel is dat de _E. coli_-bacterie relatief eenvoudig aan te passen is. Dat is ook de kracht van deze ontdekking.” Jonkheijm schat dat dit systeem binnen twee tot vier jaar zo ver is dat het getest wordt op dieren, om vervolgens het klinische traject in te gaan.
De vinding is volgens Jonkheijm mogelijk ook nog nuttig voor de productie van energie. Hij stelt zich kanaaltjes op een oppervlak voor waar de bacteriën langs bewegen en op die manier minuscule rotors aandrijven. “Of zo’n systeem veel energie opwekt? Ik heb nog geen precieze berekening gemaakt, maar ik denk wel dat je zo’n systeem enorm kunt opschalen.”