In de natuur is de snelheid waarmee iets verandert een belangrijke bron van informatie. Chemici zijn er nu in geslaagd om een heel eenvoudige gel zo te ‘programmeren’ dat snelle en langzame signalen leiden tot een verschillend effect.
Voor levende cellen is er nooit een moment van rust. Ze ontvangen doorlopend signalen die ze moeten verwerken. Signalen die aangeven dat het tijd is om te gaan delen, dat er meer van een bepaald eiwit moeten worden gemaakt of dat de stofwisseling even op een laag pitje moet. Het vermogen van cellen om signalen om te zetten in een actie is een belangrijke inspiratiebron voor onderzoekers die werken aan ‘slimme’ materialen. Dat zijn materialen die hun eigenschappen aanpassen als antwoord op signalen vanuit de omgeving, zoals licht, temperatuur of luchtvochtigheid.
Inmiddels zijn er veel voorbeelden van materialen die reageren op externe signalen en – heel belangrijk – ook weer terugkeren naar hun oorspronkelijke staat als het signaal er niet meer is. Ze kunnen bijvoorbeeld vervormen als er licht op schijnt, snel verstijven bij hogere temperatuur of van kleur veranderen als eraan getrokken wordt. Om zo dicht mogelijk bij de natuurlijke voorbeelden te blijven, werken onderzoekers meestal met zachte materialen op basis van een hydrogel. Dat is een netwerk van lange moleculen dat veel water kan opnemen en zo een flexibel en elastisch, maar tegelijkertijd stevig materiaal vormt.
Actief medium
Toch komen deze slimme hydrogels nog lang niet in de buurt van het vernuft van een levende cel. “Hydrogels zijn in deze vorm vooral een passief medium. Ze reageren wel, maar die reactie vervult verder geen eigen functie in het verwerken van het signaal”, zegt Peter Korevaar, universitair docent fysische-organische chemie aan de Radboud Universiteit. “Maar leven werkt juist in een actief medium. Een levende cel reageert niet alleen, maar beweegt ook mee door op te zwellen of te krimpen en dat bewegen heeft een duidelijke functie. Daarom wilden wij processen inbouwen in een actieve hydrogel, een gel die meedoet en een mechanische activiteit vertoont die ook iets zegt over het signaal dat is binnengekomen.”
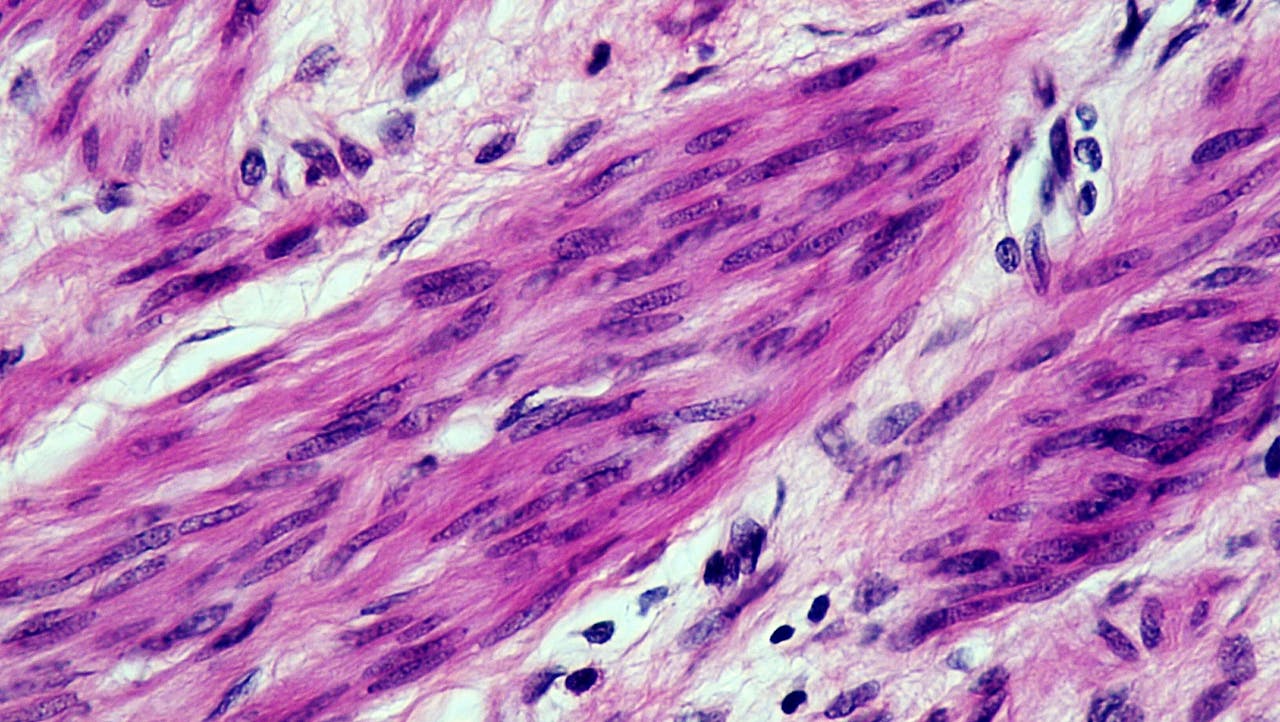
Opname van een plakje glad spierweefsel. Biologische weefsels bevatten veel water, maar zijn toch vormvast doordat het geheel is georganiseerd in cellen en de extracellulaire matrix, het materiaal waarmee cellen aan elkaar zijn verbonden en waardoor ze kunnen communiceren en gezamenlijk een functie uitvoeren. Dit levert een zacht en tegelijkertijd elastisch en flexibel materiaal dat lijkt op gel, denk aan drilpudding, haargel of gummiberen. Onderzoekers die de eigenschappen van levende cellen en biologische weefsels willen nabootsen in synthetische materialen gebruiken daarom meestal een gel die veel water bevat, een zogeheten hydrogel, als uitgangspunt.
Berkshire Community College Bioscience Image Library, Wikimedia Commons publiek domeinDe signalen waar levende cellen op reageren zijn stoffen zoals hormonen of suikers. Ook kleine geladen deeltjes zoals natriumionen uit zout kunnen een signaal zijn. Maar in een cel gebeurt altijd heel veel tegelijk en veel signaalstoffen hebben meerdere functies in verschillende processen, waardoor simpelweg de aan- of afwezigheid van een stof niet zoveel zegt. De cel registreert daarom niet alleen of een stof aanwezig is of niet, maar ook of de concentratie van de stof stijgt of daalt en vooral hoe snel die verandering gaat. Ook als het om dezelfde signaalstof gaat, kan het een enorm verschil maken of de concentratie geleidelijk of juist heel snel toe- of afneemt. Voor de cel zijn dat verschillende signalen, die om verschillende reacties vragen.
Koper en waterstof
Korevaar en collega’s uit de onderzoeksgroep van materiaalwetenschapper Joanna Aizenberg van Harvard University laten nu zien dat ook een eenvoudige, veelgebruikte hydrogel in staat is om, zoals dat heet, complex gedrag te vertonen. De signalen waarop deze gel reageert zijn waterstofionen (H+), die vrijkomen als je een zuur toevoegt, en koperionen (Cu2+) die zorgen voor een blauwe kleur. De gel is gemaakt van polyacrylzuur, lange ketens met daarin carboxylgroepen, COOH. Dat betekent een koolstofatoom, C, met daaraan twee zuurstofatomen, O, en een waterstofatoom, H, aan een van de zuurstofatomen. Onder neutrale condities, met gewoon water, is de gel opgezwollen. De H’s laten los en er ontstaan COO– groepen, dus met een negatieve lading.
Als aan deze gezwollen gel een oplossing met de koperionen wordt toegevoegd, gaat iedere Cu2+ met z’n twee positieve ladingen plakken aan twee COO– groepen. Het gevolg is dat de verschillende ketens hierdoor naar elkaar toe worden getrokken: de gel krimpt. Dat is op zich niet opzienbarend, gels die krimpen onder invloed van een signaal zijn al bekend. Maar in dit geval houdt het effect aan, ook als de koperoplossing wordt weggespoeld, blijven de koperionen in de gel plakken die daardoor samengetrokken blijft. Totdat er een volgend signaal arriveert.
De samengetrokken, blauwe gel blijkt nog steeds in staat om te reageren op verandering. Een zure oplossing, met vrije H+ ionen zet de boel in beweging. De H+ willen ook graag plakken aan de COO– groepen in de gel en dat zorgt voor een competitie met de al aanwezige Cu2+ ionen. Positief en negatief geladen ionen kunnen stevig plakken, maar ze zitten nooit onverbrekelijk vast. Het is een doorlopend proces van plakken en loslaten en weer plakken enzovoort. Zodra een Cu2+ even loslaat biedt dat kansen voor een H+ om die plek in te nemen.
Zwellingsgolf
Deze strijd zorgt voor verschillende effecten. Als er in een klap heel veel zuur van één kant wordt toegevoegd, is er daar een overmaat aan H+ die razendsnel de koperionen verdringen. De ongebonden koperionen kunnen nergens meer heen, behalve dan naar buiten, de gel uit. Dat zorgt meteen voor meer water dat van buiten naar binnen komt, waardoor lokaal de gel even weer opzwelt. De frontlinie van de strijd tussen H+ en Cu2+ is te volgen door naar de zwellingsgolf te kijken die door de gel trekt.
Wordt echter de zure oplossing heel geleidelijk toegevoegd dan is er geen sprake van een heftige botsing. Er is wel competitie tussen waterstof en koper, maar nu is er voor de koperionen meer gelegenheid om een nieuw plekje te zoeken in de gel. Ze schuiven als het ware iets op, weg van het aankomende zuurfront naar delen van de gel waar de H+-en nog niet zijn gearriveerd. Ook dit is te zien aan de gel. Nu ontstaat er geen zwellingsgolf, maar een verschuivend kleurfront. Waar de Cu2+ verdwijnt, verdwijnt ook de blauwe kleur.
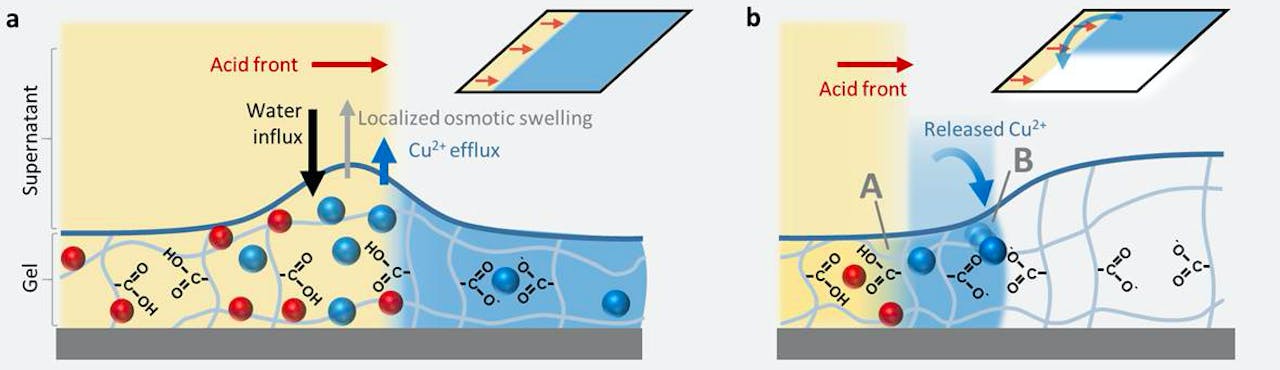
Schematische weergave van de competitie tussen de aanwezige Cu2+ ionen (blauw) en de binnenkomende H+ ionen (rood) uit de toegevoegde zure oplossing. Links de snelle verandering: er wordt veel zuur in een keer toegevoegd waardoor de koperionen vrijkomen en de gel verlaten. Dat zorgt voor een snelle invoer van water met als gevolg een lokale opzwelling die zich als een golf door de gel beweegt. Rechts de langzame situatie. Het zuur wordt geleidelijk toegevoegd en dat geeft de koperionen de tijd om elders in de gel een nieuw plekje te zoeken. De verandering is nu te zien als een verschuiving van de blauwe kleur.
P. Korevaar et al, Nature Communications (2020)Korevaar: “Onze hydrogel registreert het verschil tussen een snelle en langzame concentratieverandering en vertaalt dat in een verschillende respons. Bij mijn weten is dat nog niet eerder vertoond. Een snelle verandering zorgt voor een zwellingsgolf, terwijl bij een langzame verandering de kleur verschuift. De manier waarop de gel reageert, vertelt dus iets over de aard van het signaal.”

Vanaf de rechterkant wordt het zuur langzaam toegevoegd, waardoor de aanwezige koperionen naar links opschuiven en ook de blauwe kleur meeschuift. De patronen in de gel zijn afkomstig van kleine plaatjes die meebewegen als de gel opzwelt of krimpt. De plaatjes zijn hier toegevoegd om de bewegingen in de gel goed te kunnen zien.
P. Korevaar et al, Nature Communications (2020)Diagnostische functie
Maar kunnen we het gedrag van deze specifieke gel op deze specifieke signalen ook vertalen naar meer algemene inzichten? “Ons systeem is niet in in evenwicht, net als levende cellen dat ook niet zijn. Door te spelen met verschillende snelheden krijg je verschillende effecten. De gel die we gebruiken is heel eenvoudig. Dit werk laat daarom ook zien dat je niet per se een complex materiaal nodig hebt om een complexe functie uit te voeren.”
Zijn er ook al concrete toepassingen te bedenken voor zo’n actief meewerkende gel? Korevaar: “Onze gel laat zien dat je een materiaal verschillende dingen kunt laten doen zonder dat je elektronische aansturing nodig hebt of dat een computerprogramma eerst iets moet berekenen en bepalen. De beoogde reacties van het systeem zitten al in het materiaal geprogrammeerd.”
En waar kun je zoiets dan inzetten? “Dat zou je wellicht kunnen gebruiken om in het lichaam een diagnostische functie uit te voeren. Een heel snelle concentratieverandering in het lichaam kan betekenen dat er iets fout dreigt te gaan, terwijl een meer geleidelijke verandering gewoon een normaal verschijnsel is. Als je een systeem hebt dat snelle en normale veranderingen van elkaar kan onderscheiden kun je misschien bepaalde problemen zien aankomen en daarop inspelen. Bijvoorbeeld door ingebouwde medicatie af te geven. Dat is nog ver weg, maar ik zie het wel als een mogelijkheid.”

