Het is nog steeds een hoogtepunt in de schoolse scheikunde: de leraar gooit een stukje natrium in het water, waarna dit ontploft en een heftige steekvlam produceert. Er blijkt iets heel bijzonders te gebeuren: een Coulomb-explosie.

Menigeen zal het zich nog herinneren van de middelbare school. De onderzoekers melden dat ze bij deze voorbereidende experimenten ‘een hoop lol’ hebben gehad, een bijna schokkende bekentenis in een streng wetenschappelijk vakblad.
Nature ChemistryNatrium is een alkalimetaal, zo hebben de meesten van ons op school geleerd, en de atomen van zulke metalen staan zo graag een elektron (-) af, dat ze heftig reageren met stoffen die elektronen kunnen opnemen, zoals zuurstof. Zelfs een watermolecuul (H2O) dringen ze een elektron op, zodat dit een OH–-groep loslaat en waterstofgas (H) vrijkomt. Door de hitte die bij de reactie Na + 2 H2O -> 2 Na+ + 2 OH.. + H2 ontstaat, vliegt ook het waterstof in brand zodra het met zuurstof (in de lucht of al in het water) in contact komt.
Toch is nooit goed begrepen waarom deze reactie zo explosief verloopt – of niet trouwens: klompjes natrium in water gedragen zich grillig, soms sputteren ze alleen maar wat en lossen geleidelijk op, soms ontploffen ze pas na een tijdje, soms onmiddellijk. Dat laatste is het meest mysterieus: de reactie tussen natrium en water kan alleen aan het oppervlak van het bolletje plaatsvinden, zodat de reactiesnelheid laag zou moeten zijn. Chemische processen verlopen pas explosief als zeer veel atomen tegelijk met elkaar kunnen reageren, wat kan als je twee vloeistoffen of gassen met elkaar mengt, of vaste stoffen mengt in poedervorm, zoals in buskruit. Maar een massief blokje hout of metaal, hoe brandbaar het ook is, explodeert niet.
Ook zou er vrijwel onmiddellijk een dun laagje waterstofgas rond het bolletje moeten ontstaan dat voorkomt dat er nog meer natrium in contact komt met water, waardoor de reactie stopt tot het waterstofgas is weggestroomd, waarna de reactie weer op gang kan komen, enzovoort. Tsjechische onderzoekers hebben nu met een hoge-snelheidscamera en een procedure die goed reproduceerbare natrium-explosies maakt het raadsel opgelost. Het natrium ondergaat zodra het in contact komt met water een zeer exotisch proces: een Coulomb-explosie.

Opnames van onder de waterspiegel, 0,35 milliseconde nadat de druppel het wateroppervlak raakt. Duidelijk zichtbaar zijn de talloze stekels die in minder dan een milliseconde uit het materiaal gegroeid moeten zijn. Boven: de druppel natrium/kalium. Onder, ter vergelijking, een waterdruppel van dezelfde grootte.
Nature ChemistryOm de natrium-explosie identiek herhaalbaar te laten optreden, gebruikten de onderzoekers een mengsel van natrium en kalium (een ander alkalimetaal) dat bij kamertemperatuur vloeibaar is, zodat ze één voor een druppels van telkens vrijwel dezelfde grootte in een beker water konden laten vallen. Ook namen ze uitgebreide voorzorgen om elk contact van het natriummengsel met lucht te voorkomen (naar men aanneemt ontploffen sommige stukjes natrium niet, omdat het oppervlak al geoxideerd was).
Een camera die tienduizend beeldjes per seconde schoot, filmde het moment dat de druppel het water raakte. Het beeld is opzienbarend: in minder dan een tiende milliseconde krijgt de druppel een vacht van sprieten die uit het natrium-oppervlak wegschieten. Wat gebeurt hier?
Zodra de druppel het water raakt, schieten grote aantallen elektronen vanuit het natrium het water in. Daardoor raakt de druppel zo sterk positief geladen – en gelijke ladingen stoten elkaar af – dat het natrium zichzelf uiteen scheurt. Van de Coulomb-kracht, de kracht tussen elektrische ladingen, merken we zelden iets, omdat alle materie vrijwel evenveel positieve als negatieve ladingen bevat. Maar als positief en negatief flink uit balans zijn, ontstaan enorme krachten, vandaar de naam Coulomb-explosie.
Ook een ander welbekend schoolexperiment bij natuurkunde is een (zwakke) afspiegeling van de Coulomb-explosie: bij een persoon die positief of negatief geladen wordt, krijgen alle haren dezelfde lading, waardoor ze elkaar afstoten en overeind gaan staan. De structuur met de vele sprieten, waar ook weer kleinere sprieten uitschieten, vergroot het contactoppervlak tussen water en natrium enorm, zodat de reactiesnelheid navenant toeneemt.
De processen op atomaire schaal die hier een rol spelen zijn goed bekend, zodat je in theorie zou kunnen berekenen wat er gebeurt met een hele druppel natrium die in water valt. Maar in de praktijk is dat niet te doen, omdat het om vele miljarden atomen en moleculen gaat. Wel was het mogelijk om computersimulaties te doen met clusters van enige tientallen natriumatomen die in water terecht komen. Ook die laten zien dat het natriumoppervlak razendsnel uiteen spat zodra het in contact komt met water.
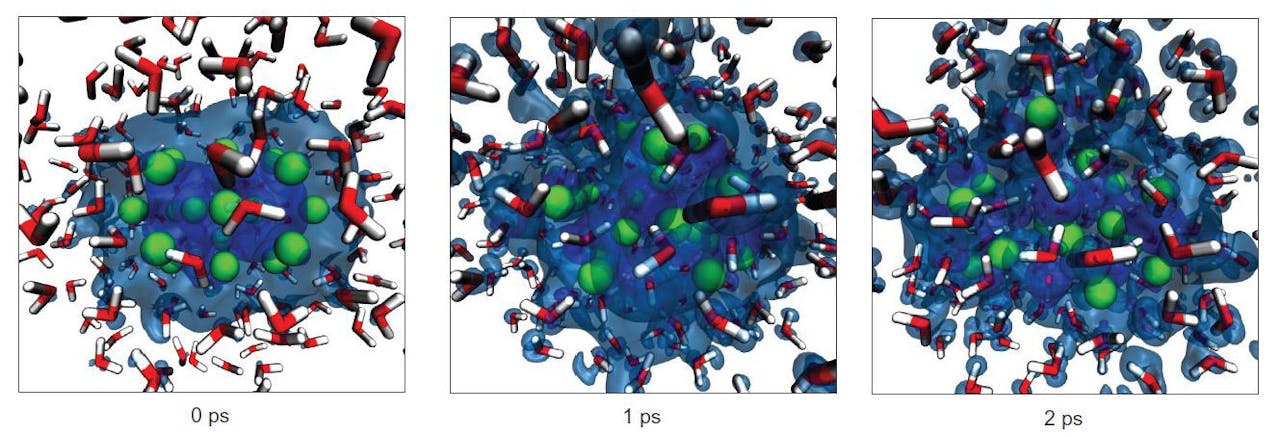
Simulatie van wat er gebeurt met een druppel van slechts enige tientallen natriumatomen in water. Groen: natriumatomen, rood/wit: watermoleculen, blauw: elektronendichtheid. Het proces speelt zich af in twee picoseconde (= 0,000000000002 ofwel 2 × 10-12 seconde)
Nature Chemistry
