Geef jij je hart aan een ander na je dood? De overheidscampagne om ervoor te zorgen dat meer mensen hun keus vastleggen in het donorregister is je vast niet ontgaan. Patiënten die wachten op een nieuw orgaan staan soms jaren op de wachtlijst. NEMO Kennislink zoekt uit of we organen kunnen maken in het lab met de huidige biotechnologische kennis en 3D-printers.
De wachtlijst voor orgaandonatie is lang. Zo lang, dat sommige patiënten de wachttijd niet overleven. Volgend jaar gaat de lijst mogelijk krimpen vanwege de nieuwe donorwet. Na juli 2020 gaat de overheid ervan uit dat iedereen akkoord gaat met het afstaan van organen na overlijden, tenzij anders aangegeven. Uit vergelijkbare wetgeving in het buitenland blijkt dat het helpt, maar het is niet genoeg om het probleem op te lossen, voorziet de Nierstichting.

Op 1 juli 2020 komt de nieuwe donorwet. In het register geef je aan of je na je overlijden organen of weefsels afstaat. In 2018 vonden er 1339 transplantaties plaats, daarvan ging het bijna 1000 keer om een nier.
Donorregister“Het is moeilijk om een goede match te vinden, dus er zal nog steeds een wachtlijst zijn”, vertelt Wouter Eijgelaar, programmamanager innovatie en valorisatie bij de Nierstichting. “Je eigen lichaam herkent dat het orgaan niet van jezelf is en stoot het af. Een orgaan dat zoveel mogelijk lijkt op je lichaamseigen cellen en organen verkleint de kans op afstoting, maar er is nog steeds heftige medicatie nodig die je afweersysteem onderdrukt. Transplantatie is op dit moment veruit de beste behandeling voor nierpatiënten, maar zeker niet de heilige graal.”
Natuur niet te evenaren
Kunnen biotechnologen dan geen organen namaken? Stel je voor: je neemt wat cellen van de patiënt, vermeerdert ze in het lab en giet ze in de juiste vorm met een 3D-printer. Onderzoekers werken er hard aan, maar een volledig orgaan maken zit er voorlopig helaas nog niet in. Een orgaan is een behoorlijk complex en harmonieus geheel. We zijn nog niet in staat om met biotechnologie zo’n complex systeem te maken.
Dat de natuur moeilijk te evenaren is, weet ook Joost Sluijter van het UMC Utrecht. Hij werkt aan het maken van de hartspier. “We kunnen wel hartspiercellen maken in een kweekbakje, maar dat is nog geen driedimensionaal hart. De spiercellen moeten samenwerken en in een vloeiende en draaiende beweging samentrekken om bloed rond te pompen. En dan mis je nog veertig procent van het orgaan dat niet bestaat uit spiercellen.” Er zullen naar alle waarschijnlijkheid zelfs cellen zijn waar wij het bestaan nog niet van afweten.

Een groot deel van het hart bestaat uit spiercellen. De wand van het hart heeft een dikke spierlaag om het bloed rond te pompen.
CC BY-NC 2.0 Sadie Thackaberry via FlickrMisschien rolt er ooit wel een volledig orgaan op maat uit het lab. Dat daar vertrouwen in is, blijkt uit gesprekken met meerdere onderzoekers die zijn aangesloten bij het initiatief RegMedXB. Het platform stimuleert onderzoek naar de genezing van chronische ziekten door middel van stamceltechnologie. Dat is niet de oplossing voor het orgaantekort, maar het biedt op kortere termijn mogelijkheden waarmee mensen die wachten op een nieuw orgaan vooruit kunnen.
Een stamcelpleister
Er wordt dus veel onderzoek gedaan naar het vervangen van delen van organen. Dat gebeurt met behulp van stamceltechniek, die veel onderzoekers over de hele wereld zich eigen hebben gemaakt. Sluijter ontwerpt hiervoor ‘gelpleisters’ met hulp van 3D-printers. Deze pleister moet het deel van het hart helen dat beschadigd is door bijvoorbeeld een infarct. In de gel zitten hartspiercellen die opgaan in de rest van het hart. Sluijter: “Uit dierproeven en onderzoek blijkt dat die cellen wel degelijk wat doen, maar ze kloppen nog niet helemaal synchroon met het hart mee, daar werken we momenteel aan.”
Naast een orgaan in het lichaam repareren, kunnen we binnenkort ook donororganen die niet helemaal in goede staat zijn opknappen. “Donoren worden steeds ouder en organen daarmee kwalitatief slechter. Er zijn steeds minder mensen die jong overlijden door een ongeluk,” vertelt Marten Engelse van het LUMC. Aan de ene kant natuurlijk positief, maar juist bij een ongeluk kwamen er relatief fitte organen beschikbaar. Wouter Eijgelaar van de Nierstichting: “We kunnen op termijn een slechte nier wel opkalefateren met stamcellen. Een volledige nier buiten het lichaam kweken is verre toekomstmuziek.” Dankzij herstel met stamcellen kunnen we de wachtlijst weer iets meer behapbaar maken, voor een nieuwe nier wachten patiënt momenteel het langst.
Lege flat
Kleine delen van een orgaan kunnen wetenschappers namaken en dat vindt langzaam zijn weg richting de kliniek. De 3D-structuur van een volledig orgaan nabootsen is een flinke uitdaging, maar ook daar wordt onderzoek naar gedaan en de eerste stapjes worden gezet. Marten Engelse van het LUMC wil een nieuwe nier maken voor nierpatiënten. Als startpunt van de 3D-structuur gebruikt hij donornieren die volledig zijn afgekeurd voor transplantatie. “We wassen een oude nier helemaal leeg, we halen alle cellen eruit en alleen de behuizing blijft over. Die vul je vervolgens met eigen gezonde cellen. Op kleine schaal in het lab werkt dit, maar we kunnen de niertjes nog niet lang in leven houden.”
De lege behuizing vergelijkt Engelse met een flat. “De huurders in de flat staan je niet aan, dus zet je iedereen eruit en maak je alles goed schoon. De lege flat heeft nog steeds een trappenhuis, badkamers en woonkamers. Laat je daar nieuwe huurders in, dan is de kans groot dat ze de keuken gebruiken om te koken, want daar stond al een kookplaat en de woonkamer maken op de plek waar je tv kunt kijken.”
“We denken dat het ook met stamcellen zo werkt. Die gaan de lege nier in, en op de plek waar normaal een plasbuis zat, zien ze aan achtergebleven eiwitten dat ze op deze plek een plasbuis moeten vormen. We bieden wel wat groeifactoren aan die de cellen stimuleren, maar we verwachten dat ze zich ook naar eigen inzicht, zoals in de flat, verder gaan specialiseren. Op deze manier laat ik de organen zichzelf organiseren. Als je handmatig elke gespecialiseerde cel op de juiste plek moet krijgen, is dat technisch niet haalbaar,” vertelt Engelse.
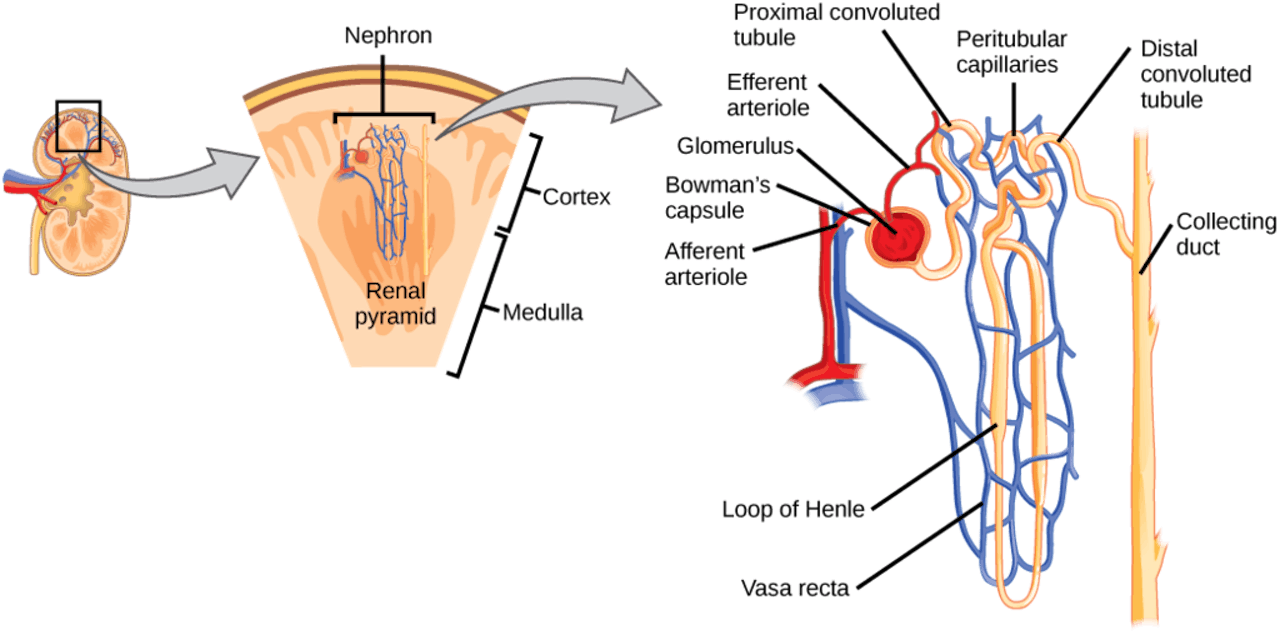
Een nier filtert afvalstoffen uit je bloed, maar je hebt niet alleen een filter nodig. Er moet toevoer zijn ongefilterd bloed, bloedafvoer en buisjes om de afvalstoffen af te voeren (uiteindelijk urine).
Boundless. “Kidney Structure.” Boundless Biology. Boundless, 08 Jan. 2016. OpenStax CNX CC BY-SA 3.0.Om de architectuur van een volledig orgaan te krijgen, lijkt zo’n structuur of mal essentieel te zijn. De losse steentjes bouwen niet uit zichzelf een heel gebouw. Toch is het op deze manier nog steeds wachten op een (afgekeurde) donornier. Kan een 3D-printer helpen om de steentjes op de juiste plek te krijgen? Volgens Engelse heeft deze technologie potentie, maar kan de juiste resolutie op dit moment nog niet worden behaald.
Laagje voor laagje
Lorenzo Moroni van de Universiteit Maastricht werkt aan het verbeteren van de 3D-printtechniek: “Met de printer zet je cellen meteen op de juiste plek. We onderzoeken welke technieken het beste werken. We printen nu vooral in losse gel-druppeltjes, maar we onderzoeken of het beter werkt als we printen met een doorlopende stroom van gelpasta. Ook verkennen we wat voor soort gel we het beste in de printer kunnen doen. De gel bevat stofjes die celgroei stimuleren en allerlei cellen die ontwikkelen tot verschillende soorten niercellen.” De eerste stappen worden momenteel gezet. Moroni’s collega Carlos Mota vertelde eerder aan NEMO Kennislink over de geprinte nefron, een nieronderdeel dat het bloed filtert.
De patiënten vestigen hun hoop op de nieuwe technieken met pleisters, printers en stamcellen. “Nierpatiënten die wij spreken zien organen uit het lab als de toekomst. Helaas komt dat voor henzelf te laat”, vertelt Eijgelaar. Het stamcelonderzoek gaat gestaag door, waardoor de nieuwe generatie hopelijk geholpen kan worden. Diabetespatiënten kunnen soms al geholpen worden met een nieuw deel van de alvleesklier, dat gebeurt momenteel op kleine schaal in de kliniek. De lever heeft in de toekomst ook een goede kans van slagen, die kan uit zichzelf al makkelijk verder groeien. Voor een nieuw hart zullen we zeker nog decennia moeten wachten.