De registratie van klinische studies op een publieke database en de tijdige rapportage van de resultaten zijn essentieel voor de geneeskunde. In Nederland kunnen wij meer doen om transparantie in klinische studies te bevorderen. Ik leg uit hoe!
Als arts-in-spe maak ik mij veel zorgen over de bewijskracht van de effectiviteit van geneesmiddelen die ik over enkele jaren aan mijn patiënten voorschrijf. Stel je voor: je bent een dokter en je wilt een medicatie voorschrijven aan een depressieve patiënt. Hoe weet je dan zeker dat het medicijn dat je wilt voorschrijven echt zijn werk doet en jouw patiënt helpt?
Dan kijk je meestal naar de uitkomsten van de nieuwste klinische studies, waarbij één groep patiënten de nieuwe pil heeft gekregen en een andere groep een neppil (placebo), zonder dat de onderzoekers of patiënten weten wie nou in welke groep zit. Dat heet een ‘gerandomiseerde dubbelblinde studie’ en is een gouden standaard binnen het medisch-wetenschappelijke onderzoek. Richtlijnen over het voorschrijven van geneesmiddelen baseren zich dan op zulk onderzoek, maar dan wordt meestal niet gebruik gemaakt van maar één enkele klinische studie.

Hoe weet je zeker dat het medicijn dat je wilt voorschrijven echt zijn werk doet en jouw patiënt helpt?
Image bij pch.vector via FreepikIn plaats daarvan maken deze richtlijnen gebruik van een overzicht van alle individuele klinische studies om te kijken of een medicijn nou wel of niet werkt. Dit heet een meta-analyse. Dat is een soort optelsom van alle klinische studies die er met een bepaald medicijn plaatsvonden. Maar wat nou als de originele data van zo’n klinische studie missen, hoe bereken je de effectiviteit dan? En wat als blijkt dat klinische studies met negatieve uitkomsten vaker in de kast blijven liggen en niet gepubliceerd worden dan onderzoeken die wel laten zien dat een nieuw geneesmiddel een positief effect heeft? En als je weet dat er soms in wetenschappelijke publicatie gesjoemeld is met de statistische methoden zodat de uitkomsten positiever lijken dan ze echt zijn als je de originele data zelf bekijkt?
Dit klinkt misschien als wetenschappelijke fraude, maar het komt helaas vaker voor dan je denkt. Om terug te gaan naar de situatie met de depressieve patiënt, dan blijkt dat klinische studies over antidepressiva met negatieve uitkomsten vaker niet verschijnen als een wetenschappelijk artikel. Daarom missen zulke klinische studies zonder publiek toegankelijke data dan in een meta-analyse, die optelsom van studies.
Bovendien worden voor sommige klinische studies de uitkomsten zo verdraaid dat ze positief lijken in de wetenschappelijke publicatie. Als een gevolg daarvan is het mogelijk dat ik als arts met mijn depressieve patiënt kan denken dat zo’n bepaald medicijn tegen depressie veel effectiever is dan tot heden toe is bewezen (Afbeelding 1). Het tijdig openbaar maken van de resultaten van klinische studies is daarom van groot belang voor de medische wetenschap maar ook voor goede, veilige, en kosteneffectieve patiëntenzorg. Dan kunnen mijn patiënt en ik een weloverwogen keuze maken welk medicijn we het beste kunnen proberen.
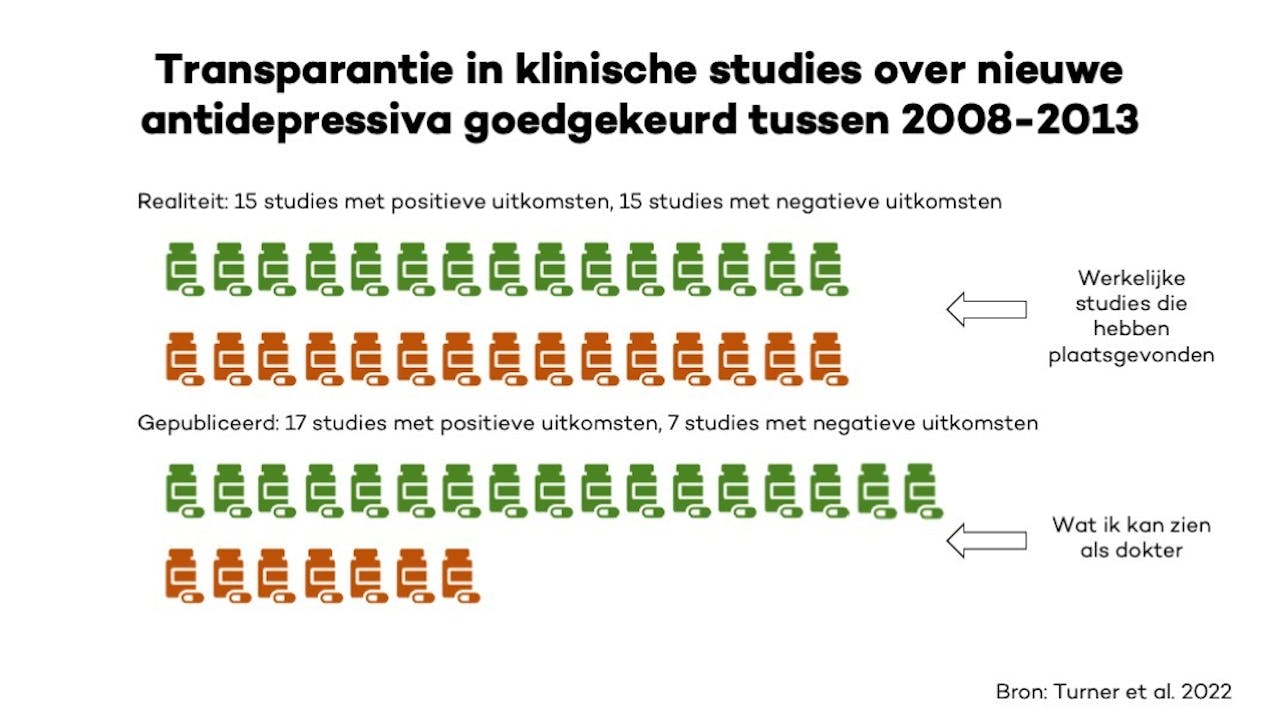
Er bestaat een discrepantie tussen de bewijskracht van de effectiviteit van nieuwe antidepressiva die ik als dokter in de literatuur kan vinden en de resultaten van klinische studies die daadwerkelijk zijn uitgevoerd.
Door Albert Hahn (1877 - 1918) - Publiek domein via wikimedia commonsTransparantie van klinische studies – een ethische verplichting
In 1964 kwam de Wereld Medische Vereniging (World Medical Association- WMA) bijeen in Helsinki, Finland om universele regels op te stellen voor het ethisch uitvoeren van onderzoek in menselijke proefpersonen. Sinds 2013 bevatten deze regels in paragraaf 35 en 36 een verplichting een onderzoek op een publiek toegankelijk register in te schrijven voordat de eerste proefpersonen meedoen aan een studie, maar ook het openbaar maken, publiceren, en verspreiden van de resultaten van het onderzoek.
Daarbij wordt de nadruk gelegd op zowel het publiceren van positieve, als ook negatieve en onduidelijke resultaten ter bevordering van de vooruitgang van de wetenschap en medische kennis. De Wereldgezondheidsorganisatie, het internationale overlegorgaan op het gebied van gezondheid voor alle landen van de Verenigde Naties (VN), stelt dat deze resultaten binnen 12 maanden na het beëindigen van het onderzoek op een publiek register moeten verschijnen. Dit omdat het vaak langer dan een jaar duurt totdat een wetenschappelijke publicatie in een tijdschrift uitkomt en de data daar niet altijd compleet zijn.
Deze deadline van een jaar is ook vastgelegd in de Europese en Nederlandse wetgeving. Maar uit onderzoek door o.a. de organisaties Transparimed, Health Action International en Universities Allied for Essential Medicines blijkt echter dat in oktober 2022 in Nederland ruim 80% van de klinische studies die voor 2015 zijn begonnen nog steeds niet hun resultaten op de Europese database hebben gepubliceerd. Het gaat hier mogelijk om honderden klinische studies door Nederlandse universiteiten en bedrijven waarvan de resultaten niet transparant in het Europese register staan.
De uitkomsten van enkele van deze studies zien mogelijk nooit het daglicht en verstoffen in een archiefkast. Zij zullen nooit gepubliceerd worden omdat ze toch niet de gewenste uitkomst hadden, het medicijn niet bleek te werken, erge bijwerkingen had in een bepaalde groep patiënten, of de bevindingen niet interessant genoeg worden geacht. Hoewel deze specifieke studies die voor 2015 begonnen nog niet onderhevig zijn aan de nieuwe wetgeving, toont het de omvangrijkheid van het probleem.
Het is niet een uniek Nederlands probleem dat resultaten van klinische studies niet tijdig gerapporteerd worden, maar wij lopen wel achter in vergelijking met landen zoals het Verenigd Koninkrijk, Duitsland, België, Oostenrijk, en Denemarken die harder aan de weg timmeren om het transparantieprobleem aan te pakken.
Hoe doen Nederlandse universitair medische centra (UMCs) het op het gebied van transparantie?
In 2021 deed ik voor het studentenblad Amsterdam Medical Student journal (AMSj) onderzoek naar het tijdig rapporteren van resultaten van klinische studies door Nederlandse Universitair Medische Centra onderzoek naar het tijdig rapporteren. Uit mijn onderzoek bleek dat maar 23% van de klinische studies door Nederlandse UMCs hun resultaten van onderzoek naar nieuwe geneesmiddelen hadden gedeeld op de Europese database, hoewel de dataverzameling van deze onderzoeken al meer dan een jaar geleden was afgerond.
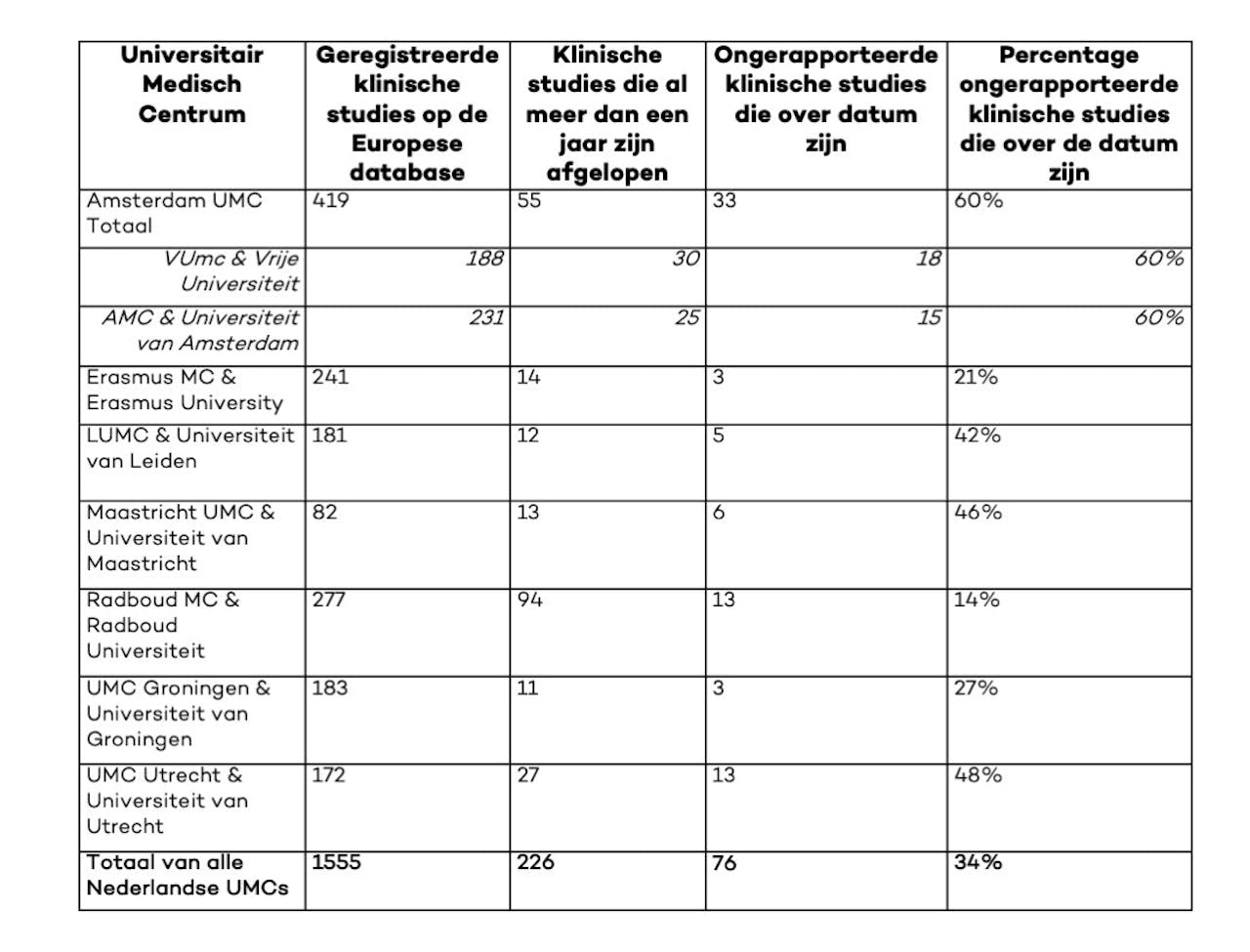
Gelukkig is er de afgelopen jaren al wat vooruitgang geboekt op dit gebied. Voor deze Faces of Science blogpost heb ik met behulp van de EU Trial Tracker dit percentage nog een keer nagerekend (tabel 1). Op 4 maart 2023 heeft 66% van de afgeronde studies die door Nederlandse UMCs geregistreerd zijn op de Europese database resultaten online staan. Dat betekent ook dat 34% van de klinische studies geïnitieerd door universitaire ziekenhuizen in Nederland nog resultaten missen (Afbeelding 2). Het gaat hier om ten minste 76 studies, met elk waarschijnlijk enkele tientallen als niet honderden proefpersonen, die niet transparant hun resultaten gedeeld hebben.
Dat is een verkwisting van de tijd, moeite, en gezondheid van de deelnemers en onderzoekers, maar kan ook belangrijke uitwerkingen hebben op de gezondheidszorg als negatieve en neutrale resultaten vaker op de plank blijven liggen. Uit het “Europese onderzoek wat wij vorig jaar publiceerden”: Europese onderzoek, blijkt bovendien dat de Nederlandse geldstrekker voor medisch onderzoek ZonMW meer kan doen om transparantie te monitoren en verplicht te stellen aan ontvangers van publieke gelden voor medisch-wetenschappelijk onderzoek.
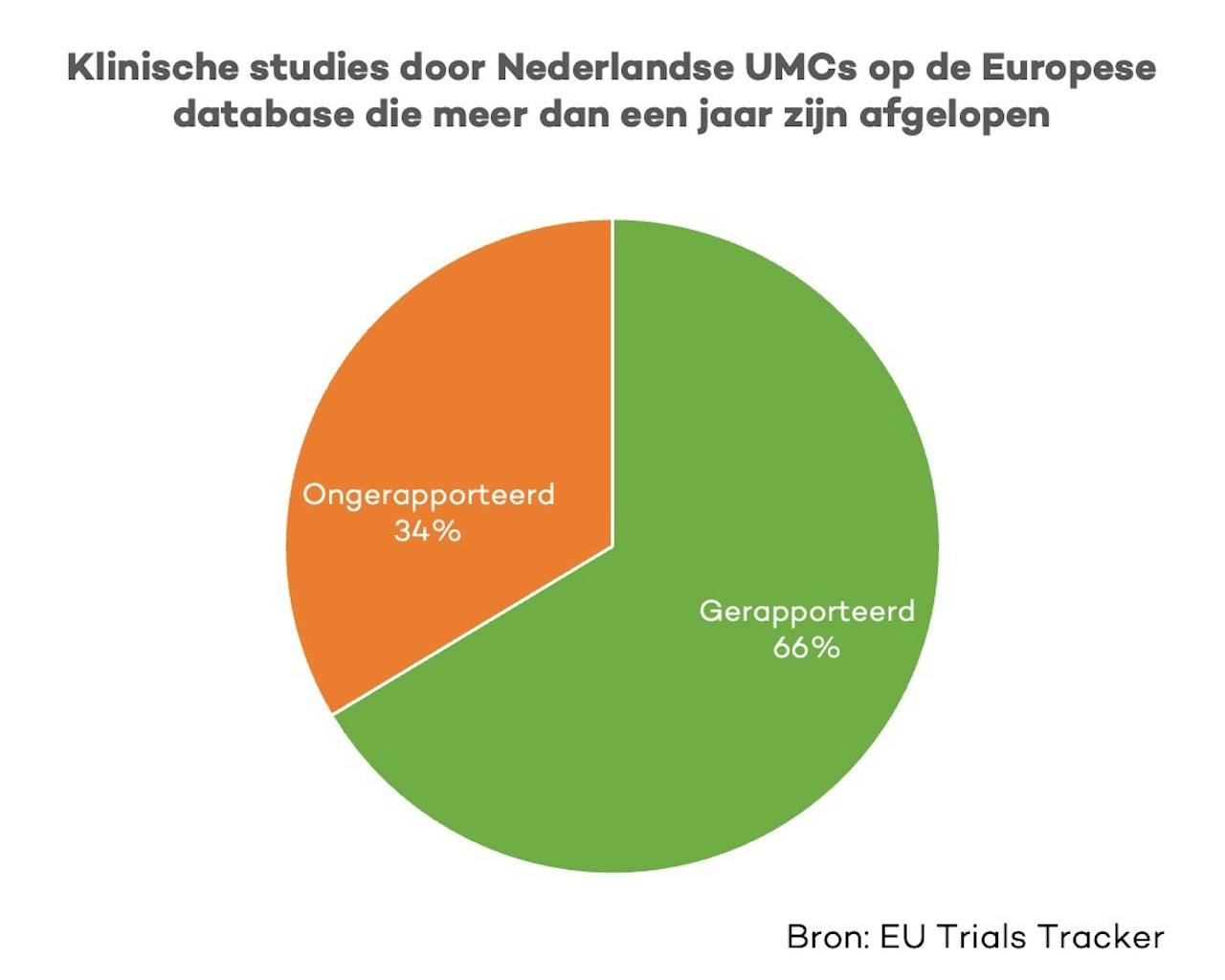
Hoewel het een ethische verplichting is om onderzoeksuitkomsten transparant te delen, mist 34% van door Nederlandse UMCs geïnitieerde klinische studies resultaten op de Europese data 12 maanden na het einde van de dataverzameling.
Trialstracker.netKan het ook anders? – een voorbeeld uit het Verenigd Koninkrijk
Sinds 2017 heb ik samen met vele andere studenten, artsen, academici, activisten, en patiëntenorganisaties in Engeland actiegevoerd voor het verbeteren van transparantie van klinische studies in het Verenigd Koninkrijk. Toen wij in 2018 met Universities Allied for Essential Medicines ons eerste rapport over Britse universiteiten in dit kader publiceerden, rapporteerden deze maar voor 29% van de onderzoeken de data op tijd op de Europese database, maar na onze campagne publiceerden universiteiten in het Verenigd Koninkrijk 91% studies van hun resultaten binnen 12 maanden.
Dit was het gevolg van een brief van bezorgde parlementariërs aan universiteiten waar zij gevraagd werden hun prestaties te verbeteren en een openbare hoorzitting over het thema. Vorige week werd aangekondigd dat nieuwe wetgeving doorgevoerd gaat worden die het niet alleen illegaal maakt om de resultaten van klinische studies te laat te publiceren, maar ook toestemming weigert voor het starten van nieuw medisch onderzoek als een universiteit of een bedrijf eerder de transparantieregels heeft geschonden. In de toekomst kan een soortgelijke wetgeving transparantie in klinische studies in Nederland bevorderen.
Hoe nu verder?
Als een jonge wetenschapper en geneeskundestudent gaat mij het gebrek aan transparantie in klinische studies erg aan het hart. Hoe kan ik later gerust medicijnen aan mijn patiënten voorschrijven als ik niet een transparant overzicht heb met de resultaten van alle eerdere onderzoeken over dit geneesmiddel? Kan ik de mogelijke bijwerkingen en kosten verantwoorden als mijn vakgenoten en ik niet alle informatie over de effectiviteit zelf kunnen beoordelen?
Om transparantie in klinische studies in Nederland te bevorderen moet eigenlijk elk onderzoeksvoorstel direct bij de toestemming van de medisch-ethische commissie geregistreerd worden op een publieke database. Dezelfde instantie kan onderzoekers eraan herinneren dat zij hun resultaten moeten publiceren binnen 12 maanden nadat de studie is beëindigd.
Als zij dat niet doen, moet dat consequenties hebben, zoals het afwijzen van nieuwe aanvragen voor medisch onderzoek in mensen totdat zij hun oude resultaten transparant delen. Onderzoekers moeten meer steun krijgen in het gestandaardiseerd en eenvoudig publiceren van hun data binnen de deadline, zodat het publiek toegankelijk is voor andere onderzoekers, artsen, en patiënten. Het is vaak niet onwil waardoor onderzoekers hun resultaten niet delen, maar een gebrek aan training over de nieuwste regels rondom klinische transparantie.
Met de website EU Trials Tracker ontwikkelden onderzoekers uit Oxford een tool waarmee iedereen makkelijk ziet welke universiteiten of bedrijven achterlopen bij het rapporteren van hun klinische studies, jij ook. Heb jij ooit meegedaan aan een studie die niet gerapporteerd is of wil je je ervaringen delen? Wil jij je ook aansluiten bij onze campagne om transparantie in klinische studies in Nederland te bevorderen? Mail mij dan via Faces of Science.