In het AMC Amsterdam doet kinderarts Jan Molenaar onderzoek aan neuroblastoom, een zeldzame maar zeer agressieve kindertumor. Met behulp van medicijnen probeert hij de ontregelde genen in de tumorcellen te remmen. Drie van die medicijnen zijn inmiddels klaar voor een test in de kliniek. Molenaar praat met Kennislink over de zoektocht naar een nieuwe behandeling tegen kinderkanker.
Neuroblastoom is een solide tumor die ontstaat vanuit het sympathische zenuwstelsel. Dit is het zenuwstelsel dat naast de wervelkolom ligt. Jaarlijks krijgen ongeveer dertig kinderen in Nederland de diagnose neuroblastoom. Daarmee is het een zeldzame vorm van kanker. Zeldzaam, maar helaas wel zeer kwaadaardig. Zeventig procent van de patiënten geneest niet en sterft aan de gevolgen van neuroblastoom of aan de bijwerkingen van de zware behandeling die wordt ingezet om de tumor te bestrijden.
“Ondanks zijn zeldzaamheid staat neuroblastoom op de tweede plaats in het lijstje van kankers waaraan kinderen het vaakst sterven”, zegt kinderarts Jan Molenaar. “Op nummer een staat leukemie. Dat is goed te behandelen, maar komt zo vaak voor dat er toch veel patiënten aan overlijden. Neuroblastoom is zo slecht te genezen dat er relatief veel patiënten aan overlijden.” Reden genoeg om onderzoek te doen naar neuroblastoom en op zoek te gaan naar een nieuwe behandeling. Kennislink sprak Molenaar over het verloop van de zoektocht.
Hoe worden kinderen met neuroblastoom op dit moment behandeld?
“Er zijn eigenlijk twee verschillende soorten neuroblastoom. Bij hele jonge kinderen, vaak jonger dan een jaar, kunnen hele grote tumoren voorkomen die ook uitzaaien, bijvoorbeeld naar de huid. Gek genoeg verdwijnen deze tumoren vaak voor een groot gedeelte vanzelf en hoeven we deze kinderen dus niet te behandelen.”
“Daarnaast komt de ziekte voor bij wat oudere kinderen van rond de drie/vier jaar. Voor die patiënten is de prognose vaak slecht. Zij krijgen een enorm zware behandeling. De eerste stap is het toedienen van een radioactief geladen neurotransmitter. De tumorcellen nemen deze neurotransmitter op met als gevolg dat ze van binnenuit worden bestraald. Daarna volgen zes kuren met een hoge dosis chemotherapie. Wat er na deze behandelingen nog over is van de tumor, wordt chirurgisch weggehaald en dan volgt nog eens een hele hoge dosis chemotherapie.”
Wat zijn de nadelen van deze behandeling?
“Chemotherapie is gif. Het maakt groeiende cellen – en dus kankercellen – dood, maar werkt absoluut niet specifiek. Ook allerlei andere cellen, zoals bijvoorbeeld de witte bloedcellen, gaan kapot. Daarom krijgen de kinderen na de chemotherapiebehandelingen een stamceltransplantatie om de cellen die verloren zijn gegaan weer enigszins aan te vullen. Een tweede nadeel van de huidige behandeling is dat kankercellen makkelijk resistent kunnen worden.”
U bent op zoek naar een nieuwe behandeling tegen neuroblastoom. Kijkt u daarbij ook naar de tumoren die vanzelf verdwijnen?
“Nee. Dat zou heel interessant zijn, maar ook in het laboratorium verdwijnen deze tumoren vanzelf en daarom kun je er erg moeilijk onderzoek aan doen. Bovendien ga je bij zulke jonge patiënten niet zomaar een biopt van de tumor nemen als al duidelijk is dat deze vanzelf weer weg zal gaan. Daarom zijn we voor ons onderzoek echt aangewezen op de tumoren die wel behandeld moeten worden.”
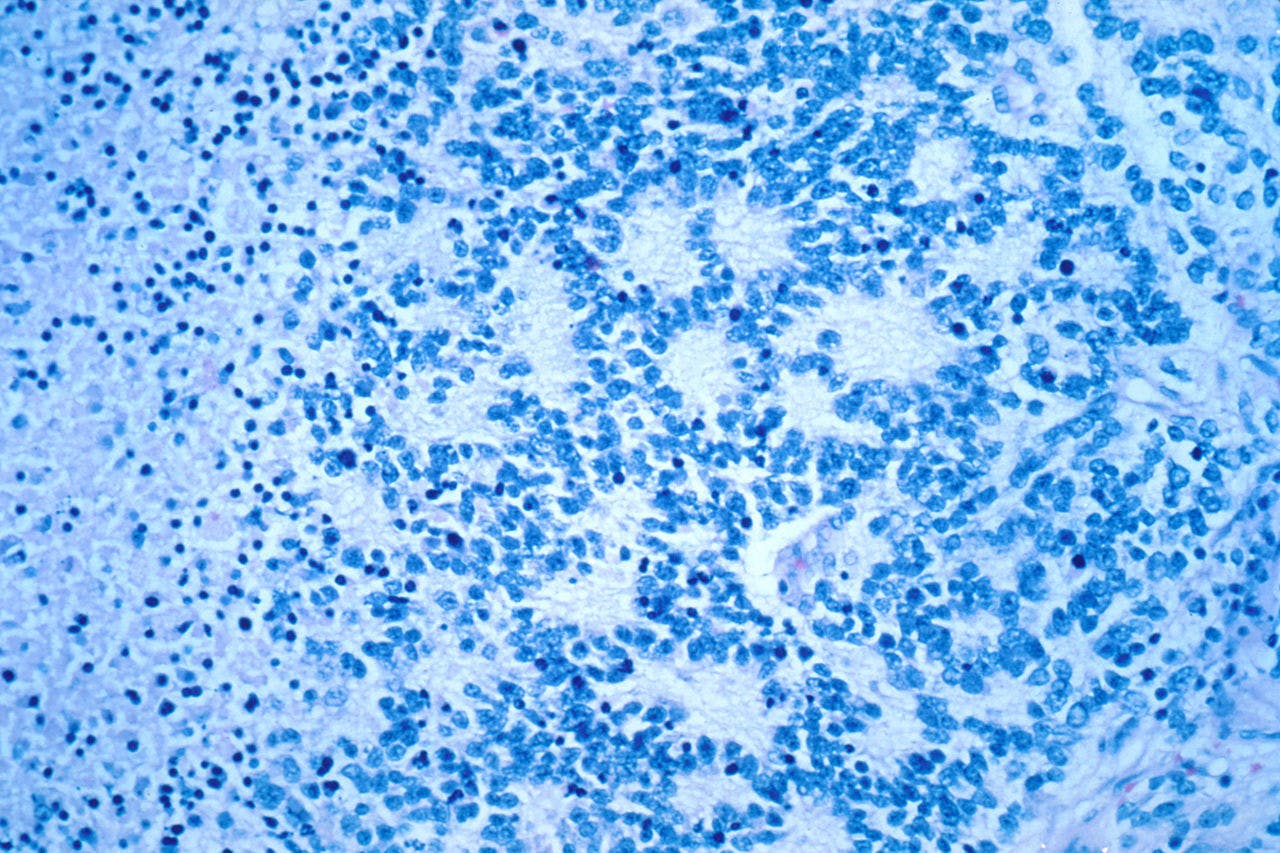
Neuroblastoomcellen rangschikken zich in een typische rosetvorm, zoals hier duidelijk is te zien.
Wikimedia Commons by CC0En wat onderzoekt u daar dan aan?
“Kanker ontstaat doordat bepaalde regelgenen in de cel veranderen. De cel krijgt daardoor het signaal om heel snel te gaan delen.
Wij hebben van honderd neuroblastoom-tumoren het complete DNA in kaart gebracht. Een hele klus, want het DNA van een losse cel bestaat uit ongeveer drie miljard basenparen. We hebben het DNA van de tumorcellen vervolgens vergeleken met het DNA van gezonde cellen van de patiënten. Zo hebben we ontdekt welke afwijkingen er precies betrokken zijn bij het ontstaan van neuroblastoom. De ontregelde genen die we hebben gevonden willen we nu proberen te remmen met medicijnen.”
Welke genen zijn er ontregeld bij neuroblastoom?
“We ontdekten dat er per tumor ongeveer twaalf genen zijn waar iets mis mee is. Maar dit zijn niet allemaal belangrijke tumor regelgenen. Kankercellen zijn erg slordig met de celdeling en maken daardoor gemakkelijk foutjes. Veel van die mutaties zijn eigenlijk niet belangrijk voor de kankergroei. We hebben dus gezocht naar genen die in verschillende tumoren aangedaan zijn, een aanwijzing dat ze van belang zijn bij het ontstaan van neuroblastoom.”
“Er zijn tien genen of genroutes waarvan wij denken dat ze belangrijk zijn en waar we nu medicijnen tegen proberen te ontwikkelen. Met drie genen zijn we inmiddels zo ver dat we een medicijn hebben wat we kunnen gaan testen in de kliniek. Dit zijn de genen CDK2, Survivin en BCL2.”
“Survivin en BCL2 zijn betrokken bij het voorkomen van celdood. Normaal gesproken maakt een cel die ongeremd gaat delen zichzelf van kant, maar bij een kankercel gebeurt dat niet. Daar zorgen deze genen voor. CDK2 speelt een belangrijke rol bij het snel delen van kankercellen, en dan met name bij het verdubbelen van het DNA.”
Kunnen we vooraf screenen op neuroblastoom nu we weten welke genen ontregeld raken?
“Nee, dit lukt helaas niet. Er zijn wel screeningsprogramma’s opgezet voor neuroblastoom, maar deze zijn allemaal gestopt. Als je op zoek gaat naar neuroblastoom vind je een hele hoop goedaardige tumoren. Maar de kwaadaardige tumoren, die je graag van tevoren op zou willen sporen, ontstaan zo snel dat je ze met screeningsprogramma’s bijna altijd mist. Vandaar dat we ons nu richten op een betere behandeling van neuroblastoom.”
Kinderarts Jan Molenaar vertelt bij Pauw en Witteman over de ontdekking van genen die een belangrijke rol spelen bij neuroblastoom.
En dat lijkt te lukken, want er zijn al medicijnen gevonden die goed werken tegen de ontregelde genen. Hoe zijn die medicijnen ontdekt?
“Neuroblastoom komt natuurlijk maar weinig voor. Daarom is het voor de farmaceutische industrie minder interessant om hier specifiek medicijnen tegen te ontwikkelen. Gelukkig is de aanpak van ontregelde genen een ontwikkeling die in het hele kankerveld zichtbaar is. Daardoor konden we landjepik spelen bij de volwassen kanker, waar wel veel specifieke medicijnen ontwikkeld worden. Omdat het bij kanker toch vaak gaat om dezelfde soort regelgenen konden we deze medicijnen ook testen op neuroblastoom.”
“Daarnaast proberen we nu ook zelf medicijnen te ontwikkelen tegen specifieke neuroblastoom genen. Daarvoor werken we samen met een laboratorium in Engeland waar een bibliotheek te vinden is met 200.000 chemische stofjes. We creëren tumorcellen waarin één van de neuroblastoom genen kapot is en kijken vervolgens welk chemische stofje het ontregelde gen het beste remt.”
Drie medicijnen zijn nu klaar voor een test in de kliniek. Stel, deze medicijnen werken, op welk moment geef je die dan aan een kankerpatiënt?
“Deze medicijnen doen het in het laboratorium goed en zijn al uitgebreid getest in allerlei modelsystemen. Ook in muizen met neuroblastoom. Maar je kunt nog zo prachtig testen, zo’n middel daadwerkelijk aan een kind geven is toch wel even iets anders. Er kunnen nog allerlei onverwachte bijwerkingen optreden, want misschien werkt het medicijn wel niet uitsluitend op het gen dat je voor ogen had.”
“Daarom is er een heel strikt traject waarin een nieuw medicijn getest moet worden. Eerst selecteren we patiënten waarbij de gewone behandeling niet meer werkt omdat de tumor resistent is geworden. Het is daarbij wel belangrijk dat de tumoren van deze patiënten afwijkingen hebben in het gen waar het medicijn tegen gericht is. We kijken of het medicijn goed werkt en of het ook bijwerkingen heeft. Als we een positief effect zien, dan gaan we het middel inpassen in de reguliere behandeling. Het is nu nog niet helemaal duidelijk wanneer we deze medicijnen zouden moeten geven, maar waarschijnlijk vrij vroeg in de behandeling, bij de aanpak van de primaire tumor.”