De Nobelprijs voor Scheikunde 2018 gaat naar Frances Arnold, George Smith en Sir Gregory Winter, voor de gecontroleerde evolutie van eiwitten. Met hun technieken maken de onderzoekers het mogelijk om biologische moleculen naar onze hand te zetten, bijvoorbeeld voor het ontwikkelen van nieuwe medicijnen of biobrandstoffen.
Bovenaan veel voorspellende lijstjes prijkten de inmiddels bekende lithium-ion batterij of CRISPR-Cas9, maar de Nobelprijs voor Scheikunde gaat dit jaar naar de gecontroleerde evolutie van eiwitten. De Amerikaanse onderzoekster Frances Arnold krijgt de helft van de prijs toegekend, de Amerikaan George Smith en de Brit Sir Gregory Winter delen de andere helft.
Eiwitten vervullen allerlei essentiële rollen in ons lichaam. Ze zijn betrokken bij ons immuunsysteem en zorgen ervoor dat onze cellen met elkaar kunnen communiceren. Veel eiwitten werken bovendien als kleine chemische fabrieken genaamd enzymen, en katalyseren chemische reacties in ons lichaam zoals het omzetten van voedingsstoffen naar energie. Evolutionair veranderen deze enzymen van tijd tot tijd door foutjes, of doordat ze reageren op veranderende omstandigheden.
Opzettelijke fouten
Arnold en haar collega’s waren in 1993 de eersten die het voor elkaar kregen om in het laboratorium deze enzymen stapsgewijs te evolueren. Met een zogenaamde PCR-methode – een manier om DNA te vermenigvuldigen – kopieerden ze het DNA van een bacterie die het enzym subtilisine E produceert, maar ze lieten er expres foutjes insluipen. Met een uitgebreide selectiemethode vonden ze zo uiteindelijk een aangepaste versie van het enzym die de gewenste reactie beter katalyseerde.
Inmiddels gebruiken honderden laboratoria over de hele wereld deze methode, vertelt hoogleraar chemische biotechnologie Dick Janssen van de Rijksuniversiteit Groningen: “Enzymen zijn van zichzelf vaak niet zo efficiënt, zeker als je ze wilt gebruiken voor reacties waar ze oorspronkelijk niet voor gemaakt zijn. Met deze methode kun je ze geschikt maken voor gebruik in de voedingsindustrie of chemische industrie, om bijvoorbeeld biobrandstoffen sneller te produceren.”
Andere soorten
De andere twee laureaten richtten zich ook op het aanpassen van eiwitten, maar dan van een ander soort. Smith keek bijvoorbeeld naar peptiden, een soort kleine eiwitten, en evolueerde hun bindings-eigenschappen met behulp van bacteriofagen, virussen die alleen bacteriën infecteren. Door de genetische informatie voor een peptide te koppelen aan bacteriofaag DNA, krijg je bacteriofagen met het peptide vast gehecht aan de buitenzijde. Smith bracht willekeurige variaties aan in deze peptiden, waardoor hij een grote collectie verschillende bacteriofagen kreeg, allemaal met net iets andere bindingseigenschappen. Vervolgens keek hij welke van deze aanpassingen goed binden aan bijvoorbeeld een antilichaam of een receptor. Alleen de peptiden die goed binden bleven achter. Deze liet Smith vermenigvuldigen in een bacterie, waardoor hij een gespecialiseerde bacteriofaag overhield. Deze techniek noemen we nu ook wel de faag display-techniek.
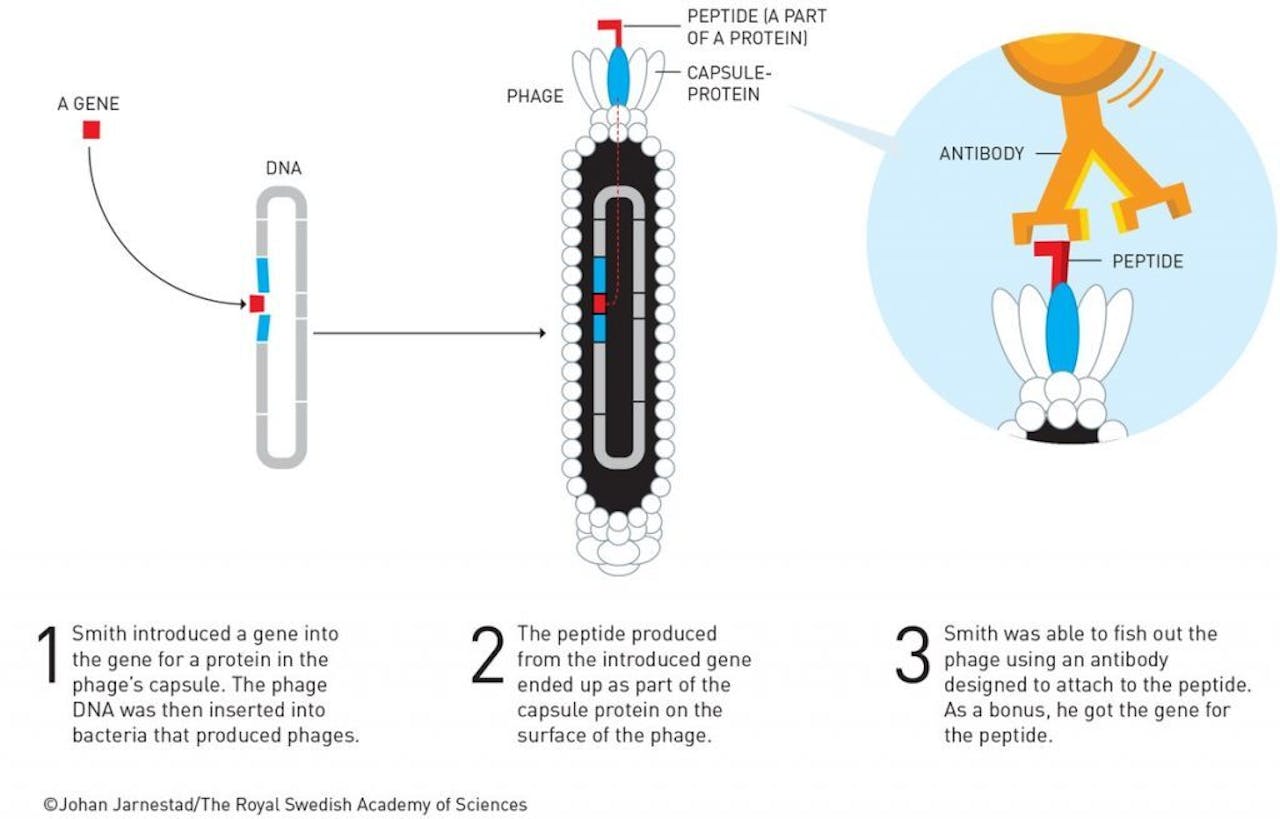
Een schematische weergave van de faag display-techniek.
Johan Jarnestad, Royal Swedish Academy of SciencesDeze techniek bleek uiteindelijk nuttig voor allerlei toepassingen. “Je kunt er bijvoorbeeld specifiek eiwitten mee zoeken die aan een bepaald enzym binden en zo de werking remmen”, legt Janssen uit. Winter, de derde laureaat, zag de techniek ook als een kans. De Brit veranderde de bindingseigenschappen van antilichamen, en creëerde zo antilichamen die erg lijken op menselijke antilichamen, maar andere bindingseigenschappen hebben en nuttig zijn als therapie tegen verschillende ziektes.
Auto-immuun
Winter probeert in zijn onderzoek onder andere auto-immuunziektes aan te pakken. In 2002 bracht zijn bedrijf Cambridge Antibody Technology het medicijn adalimumab op de markt, een behandeling voor reumatoïde artritis gebaseerd op antilichamen. En dat is nog maar het begin, denkt Janssen: “Je zou een medicijn aan het antilichaam vast kunnen maken. Dan zorg je ervoor dat het medicijn precies terecht komt waar hij moet zijn.”
Volgens het Nobelcomité gebruiken Arnold, Smith en Winter evolutie op een slimme manier, en weten ze nieuwe eiwitten te maken met nuttige eigenschappen. “Hun werk heeft chemische technieken opgeleverd die we breed kunnen gebruiken, van de ontwikkeling van milieuvriendelijk wasmiddel tot aan nieuwe biobrandstoffen en medicijnen”, zei Claes Gustafsson, voorzitter van het Nobelcomité voor Scheikunde tijdens de bekendmaking in Stockholm. “Het is een revolutie gebaseerd op evolutie.” Janssen noemt de toekenning dan ook niet meer dan terecht: “Deze onderzoekers laten zien dat het aanpassen van eiwitten een belangrijk veld is, en ik ben blij dat het Nobelcomité dat beloont.”