In ons DNA gaat doorlopend van alles mis. Toch leven we gewoon door. Dankzij het werk van Tomas Lindahl, Paul Modrich en Aziz Sancar weten we hoe onze cellen steeds weer alle fouten repareren. Ze kregen er de Nobelprijs voor de Scheikunde 2015 voor.
Niet schrikken, maar in ons DNA gaat aan de lopende band iets fout. Ons genetisch materiaal, de basis van ons bestaan, staat bloot aan heel veel invloeden die regelmatig schade veroorzaken. Dat wij en al het andere leven op aarde nog bestaan, hebben we te danken aan ons DNA-reparatiesysteem. Voor hun onderzoek naar de manieren waarop levende cellen schade aan het DNA repareren ontvangen Tomas Lindahl, Paul Modrich en Aziz Sancar de Nobelprijs voor de Scheikunde 2015.
Tot begin jaren zeventig van de vorige eeuw was de heersende opvatting onder wetenschappers dat DNA een zeer stabiel molecuul was. Dat moest wel dacht men, want in het DNA ligt alle belangrijke informatie van een levende cel opgeslagen en als die steeds zou veranderen, zou leven simpelweg onmogelijk zijn. Sporadische veranderingen traden natuurlijk wel op, anders zou er geen evolutie zijn geweest, maar dat was eerder uitzondering dan regel.
Niet stabiel
Dat we nu weten dat DNA juist helemaal niet stabiel is, danken we in de eerste plaats aan de Zweed Tomas Lindahl. Eind jaren zestig werkte hij aan RNA, een molecuul dat ook genetische informatie bevat en sterk lijkt op DNA. Hij merkte op dat RNA veel sneller dan verwacht degradeerde onder invloed van verhitting. Daardoor begon hij te twijfelen aan de vermeende stabiliteit van DNA. Klopte die veronderstelling eigenlijk wel?

Tomas Lindahl (1938, Stockholm). Promotie in 1967, Karolinska Institutet in Stockholm. Van 1978-1982 hoogleraar Medische en Fysiologische Chemie, Universiteit van Göteburg. Emeritus groepsleider, Francis Crick Institute en emeritus directeur Cancer Research UK, Clare Hall Laboratory, Hertfordshire (VK).
Holger Motzkau via Wikimedia Commons CC BY-SA 3.0Na een reeks experimenten kwam Lindahl tot een, voor die tijd, schokkende conclusie: DNA is onderhevig aan afbraak. Hij berekende dat er dagelijks duizenden keren ernstige, mogelijk levensbedreigende schade ontstaat aan het DNA.
Dat er desondanks leven mogelijk is, kon maar een ding betekenen; volgens Lindahl moest iedere levende cel beschikken over een reparatiemechanisme dat fouten kan opsporen en herstellen. Een revolutionair inzicht dat de start betekende van een compleet nieuw onderzoeksveld.
Lindahl ging op zoek naar de moleculaire componenten van zo’n reparatiemechanisme, dat volgens hem enzymen zouden moeten zijn. Het was bekend dat een van de vier bouwstenen van DNA, genaamd cytosine, relatief eenvoudig een chemische verandering kan ondergaan. Er ontstaat dan in plaats van cytosine een ander molecuul, uracil. Als dit niet hersteld zou worden, zou dat tot een fout leiden bij de celdeling wanneer het DNA wordt gekopieerd. Lindahl bedacht dat de cel dus een methode moest hebben om zich tegen deze fout te beschermen.
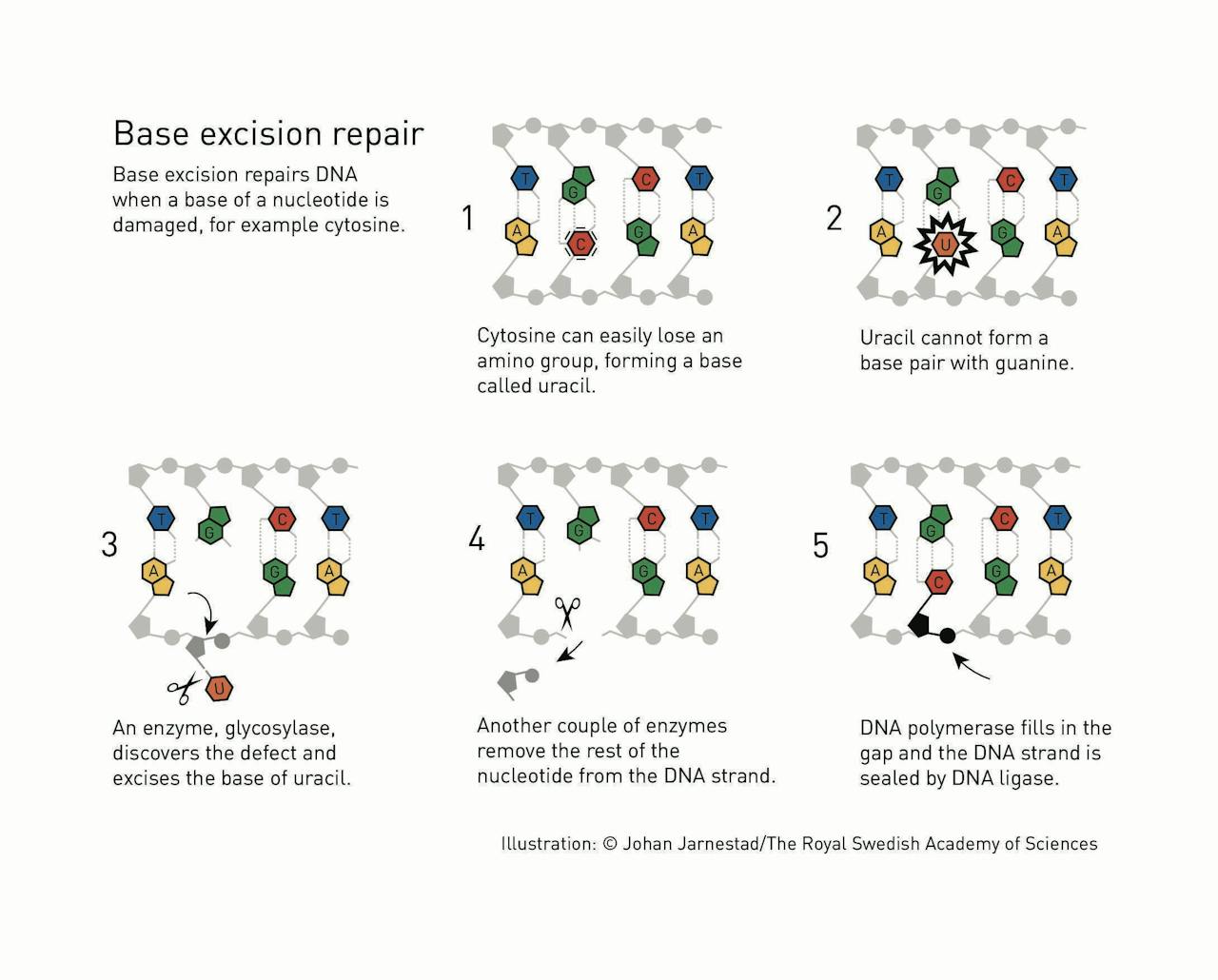
Het _Base Excision Repair_-mechanisme dat Tomas Lindahl ontdekte. De C kan soms veranderen in een U. Het enzym glycosylase herkent de U en knipt het molecuul uit het DNA. Daarna verwijderen andere enzymen de overgebleven resten en vult het enzym DNA polymerase het gat op met een nieuwe C. Tot slot plakt het enzym DNA-ligase alle losse eindjes netjes aan elkaar.
Johan Jarnestad/The Royal Swedish Academy of SciencesIn 1974 publiceerde hij de vondst van een bacterieel enzym dat een beschadigde C kan herkennen en verwijderen uit het DNA. Na nog veel meer zoeken wist hij uiteindelijk in kaart te brengen hoe een cel deze fout kan herstellen. Dat gebeurt via het base excision repair mechanisme, waarin verschillende enzymen een rol spelen. Het enzym glycosylase herkent en verwijdert de U. Vervolgens zorgen andere enzymen ervoor dat er keurig een nieuwe C wordt aangebracht. In 1996 slaagde Lindahl erin dit proces ook in menselijke cellen aan te tonen.
UV-straling
Grofweg rond dezelfde tijd dat Lindahl zijn eerste inzichten formuleerde, raakte de Turk Aziz Sancar gefascineerd door het herstelvermogen van bacteriën. Na blootstelling aan intense ultraviolette (UV) straling herstelden bacteriën zich snel onder invloed van zichtbaar blauw licht.
Hij verhuisde naar de Verenigde Staten en ontdekte in 1976 het enzym photolyase dat de UV-schade aan het bacteriële DNA herstelt. Maar hoe dat werkte, dat was nog onduidelijk.
Sancar concentreerde zich op bacteriën met een hoge gevoeligheid voor UV-schade. Hij slaagde erin de drie verantwoordelijke enzymen te identificeren en toonde daarna via experimenten in cellen aan wat de rol van deze enzymen is.
Sancar ontdekte hiermee een ander DNA-reparatiemechanisme dan Lindahl, genaamd nucleotide excision repair. In dit mechanisme wordt rond de opgemerkte fout een stuk van 12-13 ‘letters’ uit de DNA streng geknipt. Vervolgens wordt het gat gevuld met een nieuw, correct stuk DNA. Sancar publiceerde zijn resultaten in 1983 en toonde daarna aan dat alle levende cellen, ook die van mensen, beschikken over het nucleotide excision repair mechanisme.
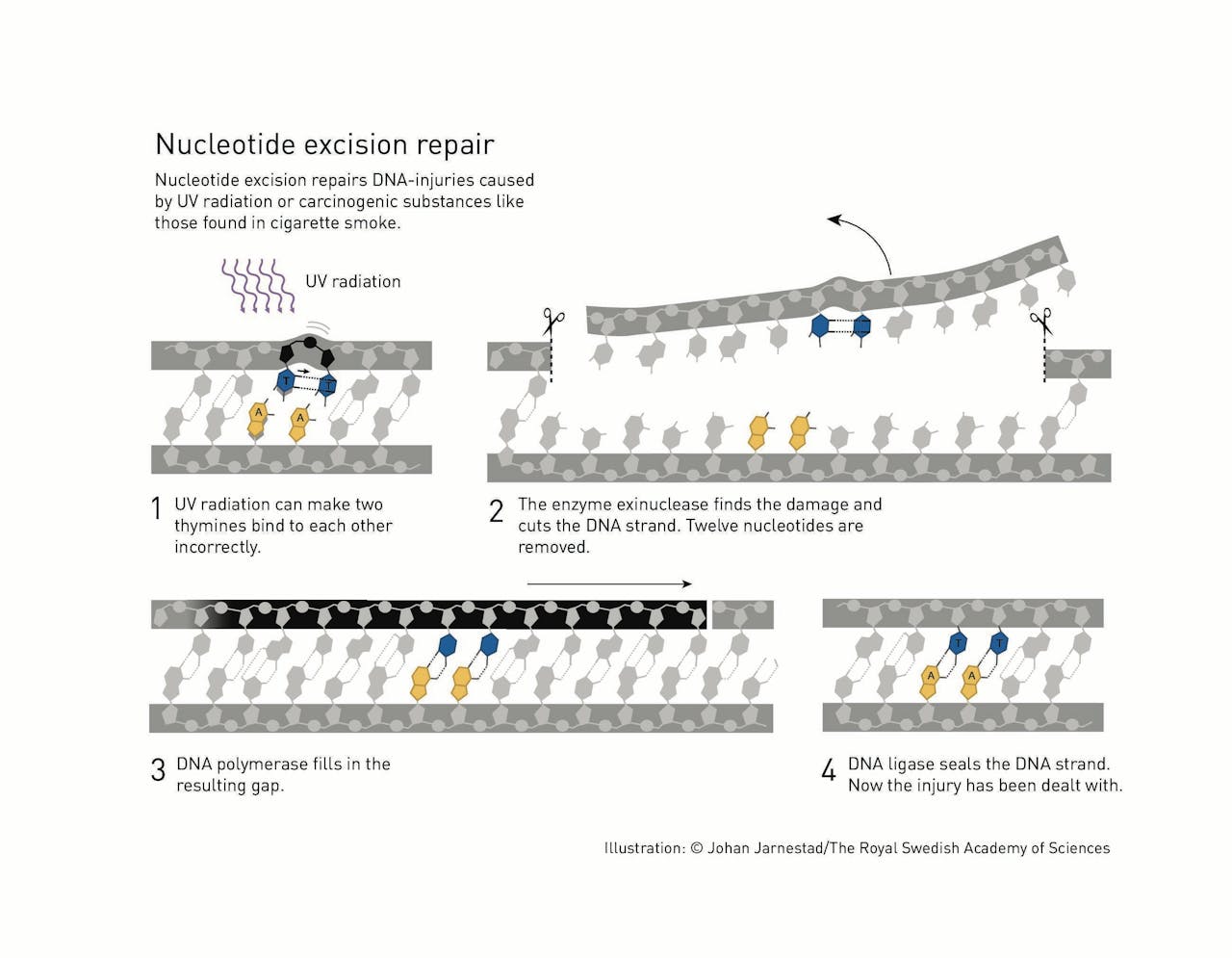
Onder invloed van UV-straling kunnen twee naast elkaar gelegen T’s aan elkaar binden, in plaats van aan de A’s die tegenover hen liggen. Sancar ontdekte het nucleotide excision repair mechanisme dat deze fout herstelt. Het enzym exinuclease knipt een flink stuk rond de fout uit de DNA streng. DNA polymerase maakt een nieuw, correct stuk dat door DNA ligase op de juiste manier in het gat wordt geplakt.
Johan Jarnestad/The Royal Swedish Academy of SciencesVerkeerde match
Dat er nog meer mogelijkheden voor DNA-reparatie zijn, bewees de derde laureaat, Paul Modrich. Hij kwam via een kleine omweg bij dit onderwerp terecht. Hij bestudeerde enzymen die een ‘iets’ met DNA deden, waaronder het enzym Dam methylase.
Dit enzym brengt methylgroepen (-CH3) aan op het DNA en Mordich opperde dat deze groepen werken als een aanwijzing voor andere enzymen om op de juiste plaats in een DNA-streng te knippen.
Dat idee paste precies bij het werk van Matthew Meselson. Deze moleculair bioloog had een virus gemaakt dat in bacteriën het DNA veranderde door een mismatch te veroorzaken. In plaats van A-T en G-C ontstonden er A-C of G-T combinaties.
Maar de bacteriën konden deze fouten herstellen. Meselson vermoedde dat de betrokken enzymen aan methylgroepen op het DNA konden ‘zien’ welke van de twee DNA strengen de correcte volgorde had en dus als sjabloon voor de nieuwe streng moest worden gebruikt.
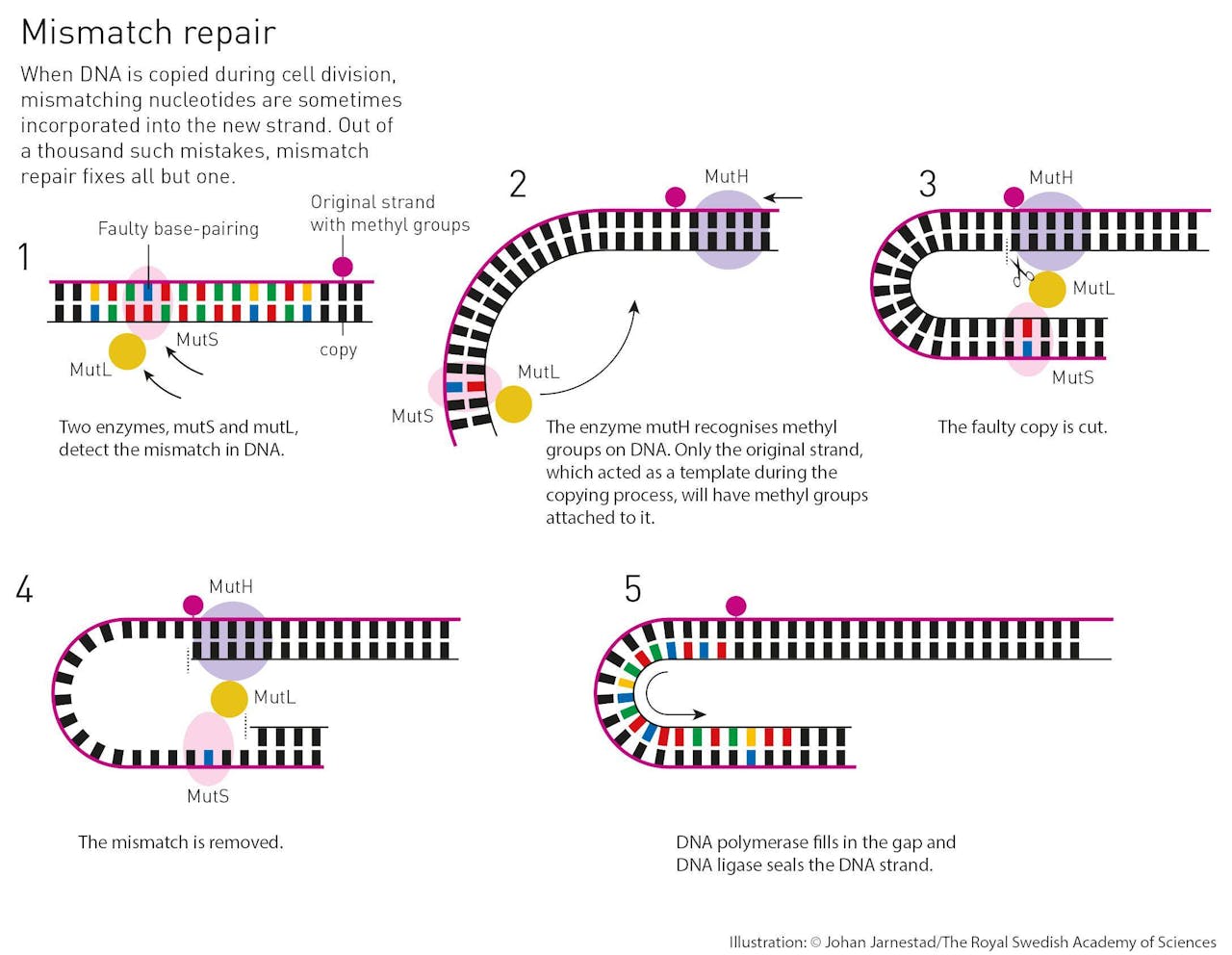
Dagelijks wordt ons DNA miljoenen malen gekopieerd tijdens de celdeling. Dat gaat niet altijd goed. Om de fouten te herstellen is er het mismatch repair mechanisme, ontdekt door Paul Mordich. Twee enzymen, mutS en mutL, herkennen de fout. De methylgroepen bevinden zich alleen op de correcte streng, die als sjabloon heeft gefungeerd. MutL herkent de methylgroep en weet daardoor welke streng fout is en dus geknipt moet worden. Het hele stuk rond de fout wordt verwijderd en net als bij de overige reparatiemechanismen zorgt DNA polymerase voor een nieuwe kloppend stuk. DNA-ligase werkt alles netjes af.
Johan Jarnestad/The Royal Swedish Academy of SciencesDaarmee overlapte zijn werk met dat van Modrich en ze begonnen een samenwerking. Het idee achter een mismatch repair mechanisme was hun beide, maar gedurende de jaren tachtig was het Modrich die stap voor stap alle elementen van het systeem in kaart bracht. In 1989 volgde de publicatie van dit derde DNA-reparatiemechanisme. In tegenstelling tot de andere twee mechanismen is van deze methode nog niet duidelijk hoe het in mensen werkt. Wij hebben het ook, maar DNA-methylering heeft in mensen een andere functie dan in bacteriën. Dit onderzoek loopt dus nog.
Levensbedreigende fouten
Naast de hierboven genoemde reparatiemethoden zijn er nog meer mechanismen waarmee levende cellen zichzelf beschermen tegen DNA-schade. En die schade ligt continu op de loer. Teveel zonlicht, roken, giftige stoffen, maar ook slordig kopiëren van DNA tijdens de celdeling; het kan allemaal levensbedreigende fouten opleveren. Zonder de bescherming van onze DNA reparatiemechanismen kunnen we niet leven.

‘Hij leunde te roken.’ Dat klinkt vreemd, omdat leunen niet behoort tot de vijf ‘werkwoorden van lichaamshouding’ zitten, staan, lopen, hangen en liggen.
Biowetenschappen en maatschappijWe weten inmiddels hoe belangrijk deze mechanismen zijn door het onderzoek naar ziekten waarbij juist deze bescherming niet goed functioneert. Patiënten met xeroderma pigmentosum zijn extreem gevoelig voor UV-straling door aangeboren afwijkingen in hun nucleotide excision repair mechanisme. Hierdoor lopen ze een zeer hoog risico op huidkanker. Een niet goed werkend mismatch repair mechanisme geeft een veel hoger risico op erfelijke darmkanker.
Bij vrijwel alle vormen van kanker werken een of meerdere DNA-reparatiemechanismen niet meer goed. Dat maakt tumoren enerzijds makkelijk resistent tegen chemotherapie omdat ze snel kunnen muteren, hun DNA kunnen veranderen. Anderzijds maakt het tumorcellen ook kwetsbaar, omdat ze ook DNA-reparatie nodig hebben voor hun voortbestaan. Dat gegeven wordt nu benut door onderzoekers om geneesmiddelen te ontwikkelen die specifiek de overgebleven DNA-reparatiemechanismen ook blokkeren, en daarmee de groei van tumorcellen stoppen.
Het werk van Lindahl, Modrich en Sancar is volgens het Nobelprijscomité van grote waarde omdat het niet alleen ons begrip van hoe levende cellen werken sterk heeft verhoogd, maar ook omdat het kan bijdragen aan de ontwikkelingen van nieuwe, levensreddende geneesmiddelen.

