De nier heeft mechanismen om zichzelf te repareren, maar deze zijn vaak niet voldoende om nierschade tegen te gaan bij nierpatiënten. Roel Bijkerk wil zelfreparatie in de nier stimuleren en start daarvoor een nieuw onderzoek in september 2017.
Vanaf zijn studententijd is Bijkerk al bezig met onderzoek naar de nier. “Een zeer complex en daardoor interessant orgaan”, zegt hij. Bijkerk, postdoc-onderzoeker bij het Leids Universitair Medisch Centrum, is vooral geïnteresseerd in het zelfherstellende vermogen van de nier.
“Onlangs is ontdekt dat cellen uit de nierfilters eigenschappen van stamcellen hebben. Dat betekent dat ze kunnen veranderen in andere cellen van de nierfilter om kapotte cellen te vervangen. Ik wil dit vermogen van de nier stimuleren, om nierschade tegen te gaan.” Bijkerk kreeg voor dit onderzoek de Kolff-subsidie van de Nierstichting.
Zelfherstellend vermogen
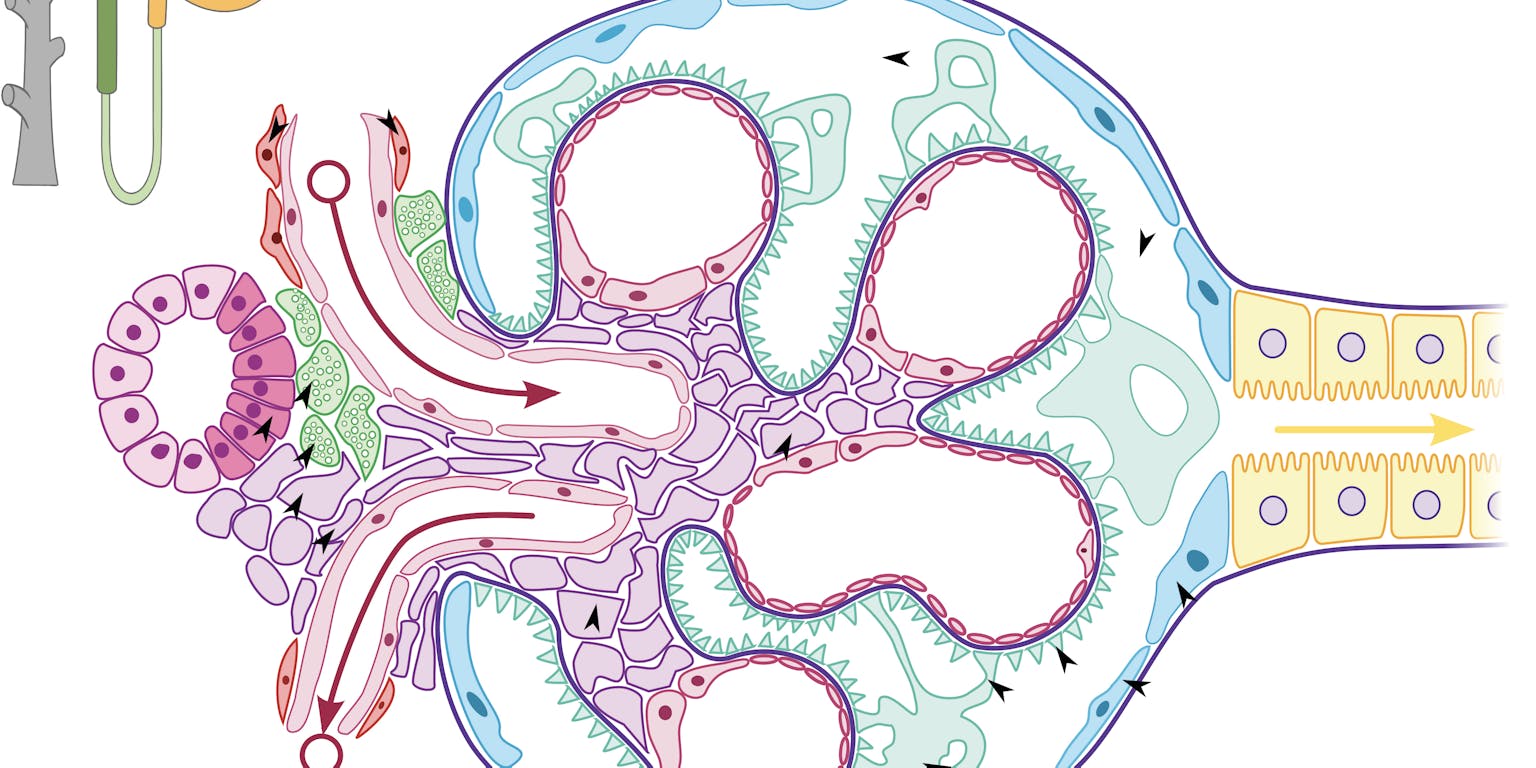
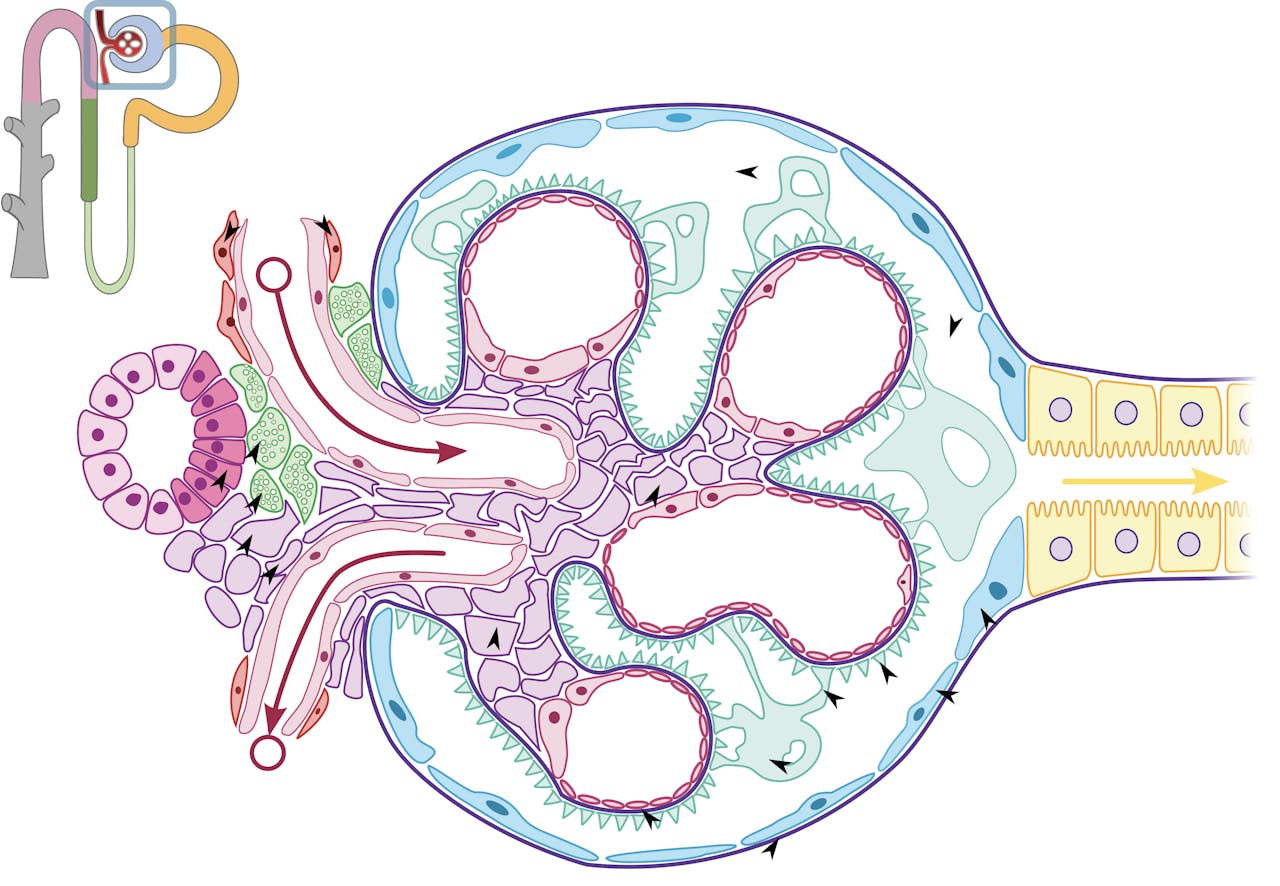
In de nierfilters zitten cellen die het hormoon renine uitscheiden (zie felgroene cellen in figuur hierboven). Renine speelt een belangrijke rol in het regelen van de bloeddruk en de water-zoutbalans in het lichaam. Amerikaanse wetenschappers lieten in 2015 zien dat deze renine-producerende cellen eigenschappen van stamcellen hebben: ze hebben de mogelijkheid om te veranderen in andere cellen van de nierfilter. Bijkerk: “In muizen waarin de nieren beschadigd zijn, zagen ze dat de renineproducerende cellen uit de nierfilters zich omzetten in andere cellen. De nier probeerde zichzelf te repareren.”
Hoe werkt dat dan precies? “Onze hypothese is dat de nier denkt dat er een te lage bloeddruk is als de nierfilters niet goed werken door schade”, legt Bijkerk uit. “Daardoor gaan de cellen meer renine aanmaken om de bloeddruk te verhogen. Maar als ze de vraag niet meer aankunnen, is dat een signaal voor de cellen om terug te veranderen in stamcellen, om meer reninecellen te maken en andere niercellen te vervangen.”
Dit zelfherstellend vermogen klinkt veelbelovend, maar helaas werkt het niet goed genoeg om chronische schade van de nier tegen te gaan. “Daarom wil ik deze capaciteit verhogen”, zegt Bijkerk.
Kleine stukjes RNA
Hij wil dat doen door middel van post-transciptionele regulatie. Dit is een vorm van regulatie van genen door RNA (een kopie van DNA, ons genetisch materiaal), waardoor meer of juist minder eiwitten worden aangemaakt in het lichaam.
In onze cellen wordt DNA gekopieerd naar RNA. De specifieke code van het RNA bepaalt vervolgens welke eiwitten er worden gemaakt. Lang werd gedacht dat er maar een soort RNA bestond: de soort die codeert voor eiwitten (‘messenger RNA’). Nu weten we dat er nog veel meer soorten niet-coderend RNA bestaan. Deze niet-coderende RNA’s maken zelf geen eiwitten, maar reguleren allerlei processen in het lichaam. Ze beïnvloeden de eiwitaanmaak door bijvoorbeeld messenger RNA’s te stimuleren of remmen.
Bijkerk doet onderzoek naar een specifieke vorm van niet-coderend RNA, namelijk micro RNA (kort: miRNA). Dit zijn kleine stukjes RNA die een rol spelen in bijna 99 procent van de processen in het lichaam.
Fluorescerend kleurtje
De micro RNA waar Bijkerk onderzoek naar gaat doen, heet miRNA-132. Eerder ontdekte hij al dat deze RNA een rol speelt bij de vorming van littekenweefsel bij nierschade. “Als we miRNA-132 remden in muizen, trad er minder verlittekening op. Maar miRNA’s kunnen meerdere processen aansturen. We zagen namelijk dat het ook een rol speelt bij de vochthuishouding: de muizen waarin we het geremd hadden, gingen meer plassen.”
Door het remmen van miRNA-132 bleek er minder antidiuretisch hormoon (ADH) te worden aangemaakt. Dit is een hormoon dat er normaal voor zorgt dat de nieren meer water en natrium terugvangen, waardoor de bloeddruk stijgt. Het remmen van ADH zorgde dus voor een lagere bloeddruk. Bijkerk vermoedt dat dit de nieren zal aanzetten om renine te produceren, zodat de bloeddruk weer stijgt. “Ik denk dat miRNA-132 invloed heeft op de reninehuishouding en daarmee op de vorming van de stamcellen in de nier. Maar hoe precies, dat weet ik nog niet en dat hoop ik in de komende jaren te ontdekken.”
Bijkerk gaat eerst testen wat het remmen of stimuleren van miRNA-132 precies doet met de renineproducerende cellen in gezonde muizen en muizen met nierschade. “We geven deze cellen een fluorescerend kleurtje, zodat we ze kunnen volgen en verder bestuderen in het lab.”
Remmend medicijn
Hij hoopt dat miRNA-132 gebruikt kan worden als remmend medicijn voor nierschade. “Of het ook een goed middel is om vergevorderde nierschade te repareren, moet nog blijken. Mijn doel is om een middel te vinden dat voorkomt dat patiënten tot eindstadium nierfalen komen. Als we dialyse met een paar jaar kunnen uitstellen, zou dat al heel mooi zijn.”
Bijkerk is niet bang dat miRNA-132 de stamcellen op een verkeerde manier stimuleert. “miRNA’s zijn finetuners, dus het loopt niet snel uit de hand. Het lastige is wel dat miRNA’s vaak meerdere processen in het lichaam tegelijk aansturen, wat voor bijwerkingen kan zorgen. Daarvoor moeten we veel en zorgvuldig onderzoek doen.”
Op het moment zijn er nog geen miRNA’s als medicijn op de markt. Dat gaat wel snel veranderen: op dit moment werkt Santaris Pharma aan Miravirsen, een miRNA tegen hepatitis C.