DNA speelt een belangrijke rol in wie we zijn en welke eigenschappen we hebben. DNA bepaalt ook in belangrijke mate onze gezondheid. Het wordt echter steeds duidelijker dat ook onze omgeving heel belangrijk is voor de activiteit van onze genen, en daarmee: voor wie we zijn. De aloude discussie over Nature versus Nurture, ofwel de (genetische) natuur versus de omgeving, is door de huidige kennis over DNA en overerving weer heel actueel.
De snelle ontwikkelingen op het gebied van genomics en bio-informatica hebben aangetoond dat de genetische code alleen de ontwikkeling en functie van cellen in relatie tot gezondheid en ziekte niet kan verklaren. Omgevingsfactoren in brede zin spelen hier ook een cruciale rol. De epigenetica beschrijft de manier waarop genen gereguleerd worden door omgevingsfactoren. Uit onderzoek aan eeneiige tweelingen blijkt bijvoorbeeld dat erfelijke aanleg voor een ziekte lang niet altijd bepaalt of je die ziekte ook krijgt. Dat wordt mede bepaald door deze omgevingsfactoren. De expressie van genen wordt geregeld door een samenspel tussen nature en nurture.
Erfelijke aanleg
Met ‘nature’ bedoelen wetenschappers doorgaans de invloed van de genetische informatie zoals die is vastgelegd in de overerfbare DNA-code. Deze code verschilt dus maar weinig tussen individuen. De subtiele variaties in DNA kunnen veranderingen in eiwitexpressie en functie veroorzaken. Die verschillen komen vervolgens tot uitdrukking in de eigenschappen van een individu, zowel fysiek en fysiologisch als in het gedrag. Ook de gevoeligheid voor omgevingsfactoren kan door deze subtiele verschillen veranderen.
Het begrip ‘nature’ wordt vaak geassocieerd met de klassieke evolutietheorie van Charles Darwin. Die stelt dat voordelige eigenschappen in de evolutie van een soort prevaleren: de spreekwoordelijke survival of the fittest. Selectie gedurende vele generaties zorgde voor het aanpassen van soorten aan de omstandigheden. Ten tijde van het Humane Genoomproject was de overheersende mening dan ook dat we met de sequentie van het genoom de gouden sleutel in handen zouden hebben voor het begrijpen van het leven op aarde, inclusief het ontstaan van ziekten.
Toch zijn we genetisch gesproken nog dezelfde als de holbewoners die we millennia geleden waren. De DNA-code is op een enkele uitzondering na niet echt veranderd. Daar is meer voor nodig.
Omgevingsinvloeden
Met ‘nurture’ bedoelen we doorgaans de invloed van persoonlijke omstandigheden en ervaringen op de gezondheid van een individu, zoals levensstijl, opvoeding, blootstelling aan milieufactoren, stress of voeding. Lange tijd geloofden maar weinig wetenschappers dat onze omgeving een directe invloed kan uitoefenen op de werking van onze genen. Jean-Baptiste de Lamarck, een negentiende-eeuwse evolutiebioloog en voorganger van Charles Darwin, werd om dat standpunt zelfs tot voor kort nauwelijks serieus genomen.
Inmiddels weten we dat omgevingsfactoren wel degelijk een effect hebben op de genregulatie. Dat kan doordat het ingepakte DNA in de kern chemisch wordt aangepast, bijvoorbeeld door de eerder genoemde methylering van het DNA of de chemische verandering van de histonen. Het gaat hier om een complex, maar toch steeds beter begrepen systeem, waar onder andere veel enzymen bij betrokken zijn.
Epigenetische genregulatie, dus onder invloed van de omgeving, kan ervoor zorgen dat een cel deelt en onze lichaamscellen hun eigen functie krijgen, dat een foetus zich gezond ontwikkelt, dat we in staat zijn te reageren op een plotseling veranderende omgeving en dat we ouder worden. Omgekeerd kan ontsporing van deze epigenetische genregulatie leiden tot miskramen, groeistoornissen, kanker, hart- en vaatziekte en ook psychiatrische ziektebeelden. Daarbij kunnen grote etnische verschillen optreden, net zoals grote verschillen tussen man en vrouw.
Uit divers wetenschappelijk onderzoek is gebleken dat blootstelling aan een veranderend milieu en voeding van invloed is op het epigenoom. Zo is duidelijk dat honger of een dieet met te weinig foliumzuur (een belangrijke bron voor methylgroepen) in muizen onder andere de epigenetische genregulatie van de kleur van de vacht verstoort. Veranderde methylering van weer andere genen in het muizengenoom kan leiden tot obesitas, diabetes of kanker. Deze effecten worden nog versterkt wanneer deze muizen de stof bisfenol-A in hun dieet krijgen. Dit is een stof die overal in het milieu voorkomt, onder andere in plastics. Bisfenol-A beïnvloedt de methylering van DNA. Foliumzuur in het dieet heeft juist een beschermend effect op de negatieve invloeden van bisfenol-A.
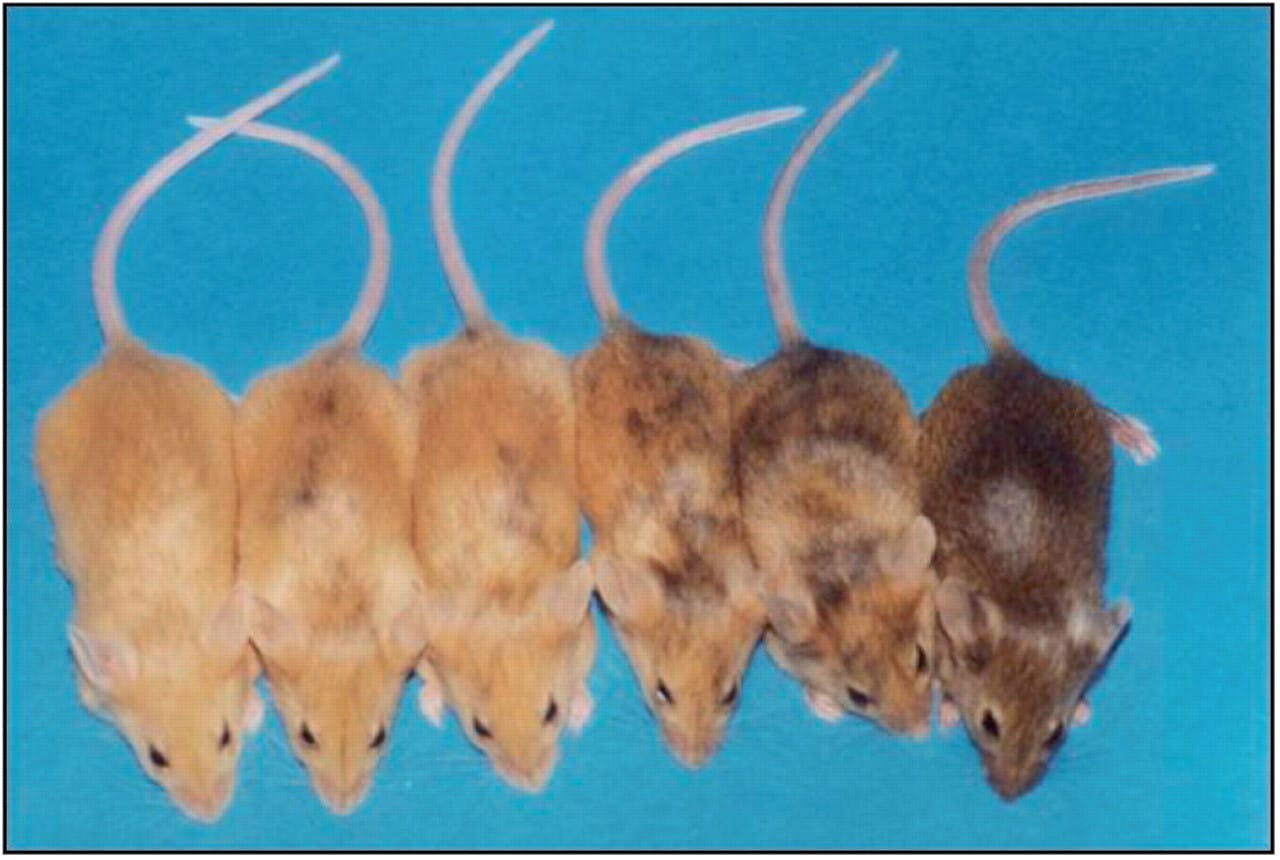
De hoeveelheid foliumzuur in het dieet van de moedermuis, kan langs epigenetische weg de vachtkleur van de nakomelingen beïnvloeden.
Professor Emma Whitelaw, QIMR BerghoferDe hongerwinter
Nederlands onderzoek naar de late effecten van de Hongerwinter van ’44-‘45 is wereldwijd een van de meest spraakmakende onderzoeken op het gebied van voeding en epigenetica. Dit grootschalige onderzoek in Leiden en Amsterdam heeft laten zien dat langdurige ondervoeding van zwangere vrouwen voor veel gezondheidsproblemen zorgt bij hun nageslacht, vooral als er sprake was van ondervoeding in het begin van de zwangerschap. Onderzoek aan het epigenoom van ‘hongerwinterkinderen’ laat inderdaad zien dat een afwijkende methylering van genen verantwoordelijk is voor de late gezondheidseffecten.
Soortgelijk onderzoek is ook gedaan bij ziekten als obesitas en type-2 diabetes, waarbij de omgeving in de vorm van de voeding in belangrijke mate het ziektebeeld bepaalt. Hier zijn ook grote verschillen zichtbaar tussen verschillende etnische groepen. Bijvoorbeeld migratie naar een westers land met de bijbehorende verandering van leefstijl en voeding kan dergelijke ziekten introduceren in de migrantengroep.
Met nieuwe moleculaire technologie is grootschalig onderzoek naar de methylering van het epigenoom mogelijk geworden. Op die manier kunnen we niet alleen naar de verschillen in DNA tussen mensen kijken, dus naar het genoom, maar ook naar epigenetische verschillen tussen verschillende groepen patiënten en gezonde controlepersonen. Een goed voorbeeld daarvan is een onderzoek naar het foetaal alcoholsyndroom.
Proefdieronderzoek heeft duidelijk laten zien dat alcohol in potentie een effect heeft op de aanleg van het epigenoom. Daarom heeft de onderzoeksgroep Genoomdiagnostiek in het Academisch Medisch Centrum in Amsterdam de invloed onderzocht van alcoholmisbruik gedurende de zwangerschap.

Roken en drinken tijdens de zwangerschap hebben een grote invloed op het epigenoom van het ongeboren kind.
ShutterstockVoor dit onderzoek zijn genetische en epigenetische gegevens verzameld van kinderen met het foetaal alcoholsyndroom. Dat syndroom kenmerkt zich door vertraagde groei, gezichtsafwijkingen en ook ernstige neurologische afwijkingen. Na onderzoek van niet minder dan 450 duizend specifieke stukjes DNA van patiënten, bleek dat in een groot aantal genen de methylering was veranderd onder invloed van de alcohol.
Dit suggereert dat de activiteit van de betrokken genen ook sterk is veranderd. Het ging met name om genen die betrokken zijn bij de neurologische ontwikkeling en groei, maar ook genen die weer betrokken zijn bij de regulatie van verschillende andere genen. Daarmee zou het effect dus heel breed kunnen zijn. Door deze veranderingen ook in een grotere groep patiënten te bestuderen, moet duidelijk worden hoe dit syndroom ontstaat en hoe ernstig de verschillende klinische eigenschappen zijn. Mogelijk kunnen de veranderingen in het epigenoom zelfs worden gebruikt om de diagnose ‘foetaal alcoholsyndroom’ in een vroeg stadium te stellen, of voor het inschatten van een prognose.
Stress en andere epigenetische drama’s
Naast voeding spelen ook andere omgevingsfactoren, zoals algemene leefstijl, opvoeding en stress een belangrijke rol bij het ontstaan van ‘epigenetische ziekten’. Uit een groot onderzoek in de jaren negentig, onder 17 duizend proefpersonen, bleek bijvoorbeeld dat een opeenstapeling van traumatische jeugdervaringen, zoals mishandeling of verwaarlozing, tot veel problemen op latere leeftijd leiden op het gebied van sociale, emotionele en cognitieve ontwikkeling en risicovol gedrag.
Er was bovendien een sterk verhoogd risico voor hart- en vaatziekten en voor het slecht functioneren van de afweer tegen ziekten. De neurologische ontwikkeling had ook te lijden onder het vroegere misbruik, net als de stress respons. Manisch-depressiviteit en het posttraumatisch stress-syndroom kwamen vaker voor. Voor een deel zijn de problemen te verklaren uit risicovol gedrag, zoals drugsgebruik of eetstoornissen. Kinderen ontwikkelen dat gedrag om de emotionele pijn te dempen. Er is echter ook een directe biologische verklaring voor hun gezondheidsproblemen.
De afgelopen jaren is uit dierexperimenteel onderzoek en onderzoek aan weefsel van zelfmoordslachtoffers bekend geworden dat traumatische stress op de kinderleeftijd veelvuldig leidt tot een blijvende verstoring van het hormonale stress-systeem. Dit gebeurt via demethylering van de genen die betrokken zijn bij de stressrespons. Door deze veranderde epigenetische programmering is het gewone, basale stressniveau van deze patiënten vaak blijvend te hoog, met veel gezondheidsproblemen als gevolg. Ook een groot aantal genen die betrokken zijn bij belangrijke biologische processen zoals het immuunsysteem waren blijvend ontregeld bij veel slachtoffers van kindermishandeling.
Omdat epigenetische genregulatie in de baarmoeder en op jonge leeftijd een belangrijke rol speelt bij de ontwikkeling van het kind, mag je aannemen dat verstoring van deze epigenetische regulatie op jonge leeftijd leidt tot gezondheidsproblemen. Waar bij volwassenen sprake is van vernieuwing van slechts enkele hersencellen per dag, groeit het brein van een kind in wording met 20.000 cellen per seconde. Het jonge leven is daarmee extra kwetsbaar, net als het jonge epigenoom.

