Of je ziek wordt van een virus, hangt voor een groot deel af van je immuunsysteem: hoe beter het werkt, hoe minder ziek je wordt. Maar wat is goed? En uit welke onderdelen bestaat het immuunsysteem eigenlijk? Daar weten we op genetisch niveau nog lang niet alles van. De moeilijkheid: bij je immuunsysteem is een kwart van al je twintigduizend genen betrokken. Bioinformatici van het Virgo onderzoeksconsortium beten zich vast in het uitzoeken welke genen wat precies doen.
Stel. Je bent een virus, en je wordt ingeademd door een mens. Wat doe je dan? Je wílt heel graag jezelf vermenigvuldigen, maar daar heb je een gastheercel voor nodig die je van de nodige onderdelen kan voorzien om een kopie van jezelf te maken. Je vindt die gastheercel ook wel, na een tijdje. Je hebt jezelf behangen met eiwitten die als een soort sleutel functioneren om de juiste gastheercel te herkennen en er toegang toe te krijgen.
Gastheren
Ben je eenmaal binnen, dan kan het vermenigvuldigen beginnen. Je neemt de controle over de cel over, zorgt dat de cel jou gaat vermenigvuldigen, en al je nakomelingen gaan op zoek naar nieuwe gastheercellen. Je bent heel succesvol: jouw acties leiden tot een kettingreactie en met een beetje mazzel worden je nakomelingen uitgehoest door die mens. Kunnen ze opnieuw op zoek naar nieuwe gastheren.
Die gastheercellen raken beschadigd of gaan dood en de mens die als gastheer optreedt, wordt ziek doordat zijn cellen aangetast raken. En zo ontstaat een infectie van ebola, HIV, hepatitis, verkoudheid, Zika, griep of welk ander virus dan ook. De ziekteverschijnselen hangen af van het soort cellen dat het virus als gastheercel kan gebruiken. Als je er even over nadenkt, is het een wonder dat we inmiddels met zeven miljard mensen zijn: het wemelt van de virussen, en het zijn lang niet allemaal lieverdjes.
Plato’s grot
Maar wacht eens even: zo’n gastheer is natuurlijk ook niet gek. Vreemde virussen die binnendringen, dat kan zo maar niet! Dus als reactie gaat de gastheer proberen de virussen tegen te werken, bijvoorbeeld door eiwitten te bouwen die zodanig aan een virus plakken, dat hun ‘sleutel’ nergens meer op past. Om dat te kunnen, moet een gastheer virussen herkennen als indringer, en dat herkennen is deels gebaseerd op eerdere ervaringen met binnendringers, en deels aangeboren: in onze genen hebben we tal van codes opgeslagen waarmee je eiwitten kunt maken die virussen kunnen signaleren en die andere delen van het immuunsysteem aanzetten tot actie.
Virologen proberen heel goed in de vingers te krijgen welke eiwitten een virus gebruikt bij het binnendringen van een gastheer, en welke tegenmaatregelen die gastheer neemt. Als je je in dát strijdgewoel mengt, kun je immers met een vaccin of medicijn virussen uitschakelen nog voor ze goed en wel geland zijn.
Maar hoe ziet dat strijdtoneel eruit? Welke eiwitten worden er dan gemaakt? Met behulp van welke genen? “Je kunt wel bijvoorbeeld het mazelenvirus bestuderen, maar dan weet je vooral hoe het zit bij mazelen. Een deel van de genactiviteit in het immuunsysteem die je dan meet, is specifiek voor mazelen. We willen weten wat er generiek gebeurt. Daar heb je in de bestrijding van veel meer virussen iets aan”, zegt Martijn Huynen, hoogleraar aan het Centre for Molecular and Biomolecular Informatics van het Radboudumc in Nijmegen. “En zo geldt het voor elke ziekte. Eigenlijk zitten we als wetenschappers in Plato’s grot: we proberen de werkelijkheid te bestuderen door te kijken naar schaduwen van wat er gebeurt.”
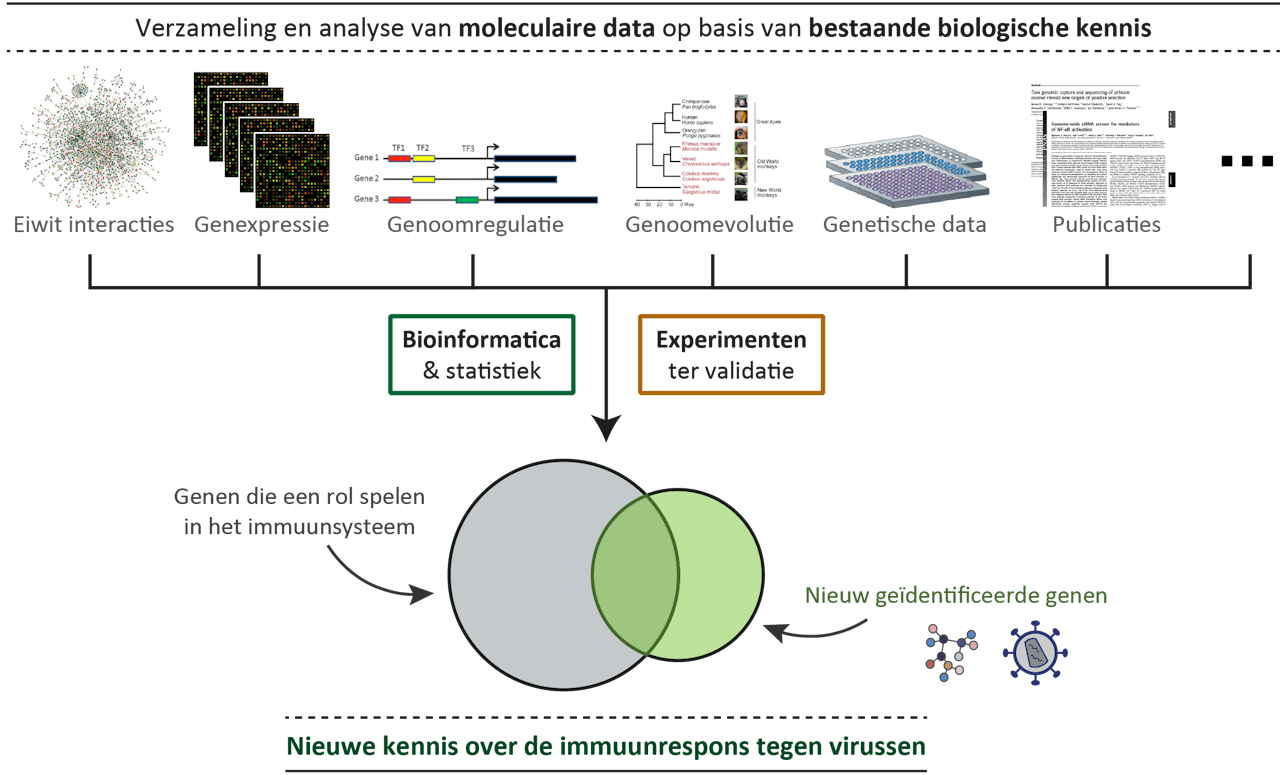
De bioinformatici ontleenden hun model uit zeer veel verschillende bronnen: van eiwitinteracties tot genexpressie tot (zoals in de tekst beschreven) genoomevolutie.
Robin van der Lee, Radboud umcDatasets
De puzzel van ons immuunsysteem is bij lange na niet compleet en van veel genen waarvan inmiddels bekend is dat ze iets doen in onze immuunreactie, is helemaal niet duidelijk is wàt ze precies doen. Genen maken een eiwit, en we hebben geen idee waar het voor is. Virologen komen daar niet altijd goed uit, omdat ze vaak erg betrokken zijn bij de studie naar één bepaald virus. Ze missen daardoor overzicht. “Dat is waar wij het leuk beginnen te vinden”, vertelt Robin van der Lee, projectleider bij het Radboud en bioinformaticus. Bioinformatici werken met grote verzamelingen van biomedische data. Zo een dataset bevat bijvoorbeeld informatie over DNA, dat het erfelijk materiaal bevat van een of meerdere mensen of dieren. Geen van die datasets levert op zich extra inzicht over het totale immuunsysteem, maar de combinatie doet dat wel. Dus maken ze gebruik van heel veel datasets.
Sleuteleiwitten
Van der Lee en Huynen vergeleken bijvoorbeeld DNA van mensen, mensapen en andere apen die evolutionair verder van de mens vandaan staan. Van steeds meer dieren komen DNA-sets beschikbaar, en de bioinformatici zochten daarin naar iets heel speciaals: DNA dat veel mutaties had ondergaan en méér mutaties dan je normaal gesproken zou verwachten. Dat lijkt op het eerste gezicht wat merkwaardig, maar de gedachte erachter is helder: virussen en het immuunsysteem zijn al miljoenen jaren in een soort kat-en-muisspel met elkaar verwikkeld. Een virus moet z’n eiwitten die zorgen dat hij vat heeft op een gastheer snel kunnen aanpassen, anders zijn er al heel snel geen gastheren meer die niet immuun zijn geworden. Die sleuteleiwitten muteren daarom heel snel, en het immuunsysteem past zich daar weer snel op aan. Kijk je dus in een vergelijking tussen mens, bonobo en makaak naar de eiwitten die het snelst zijn geëvolueerd, dan weet je dat die immuun-eiwitten ertussen zitten.
Statistische hoofdbrekers
Een andere, erg bruikbare dataset is die van genen waarvan we weten dat hun eiwitproducten interactie aangaan met virussen. Zo legden Huynen en Van der Lee verschillende sets naast elkaar die nog nooit in combinatie waren bestudeerd. Die data komen uit medisch onderzoek – soms virologisch, soms totaal iets anders, zoals bijvoorbeeld stofwisselingsziekten. “Andere onderzoekers hebben daar vaak heel nuttige inzichten uit gehaald. Zo zie ik ons werk ook: veel brokken direct bruikbaar materiaal zijn al uit dat soort data gehaald. Wij zijn net modderkruipers die het doen met de restjes die naar beneden dwarrelen.”
Het verschil zit erin dat de bioinformatici datasets combineren. Daarna volgt een lastige statistische klus. Huynen: “Als je gewoon gaat turven welke genen in al je sets zitten, dan houd je geen enkel gen meer over. Dus dat werkt niet. Je moet gaan uitrekenen in welke mate, en met welke waarschijnlijkheid, een gen betrokken is bij het immuunsysteem. Je moet ‘gewogen’ gaan turven.”

Dit laat een netwerk van genen zien die betrokken zijn bij de immuunrespons tegen virussen. De cirkels zijn de genen, de verbindende lijnen stellen interacties tussen de genen voor (dat wil zeggen: verbonden genen hebben iets met elkaar te maken). Voor groene en blauwe genen was al een functie bekend binnen het immuunsysteem. Voor de overige genen heeft Virgo met de combinatiemethodologie aan kunnen tonen dat ze ook belangrijk zijn voor de antivirale afweer.
Robin van der Lee, Radboud umcNa vele statistische hoofdbrekers hielden Van der Lee en Huynen een verzameling van een paar honderd genen over. “Het was verschrikkelijk veel werk om al die genen een voor een te bekijken om te zien wat ze eigenlijk doen in het immuunsysteem”, vertelt Van der Lee.
Controleren
“Het lijkt of je dan klaar bent, maar dan vergeet je één essentiële stap: experimenteel controleren of je gelijk hebt”, zegt Huynen. “Die stap missen bioinformatici nog weleens. Maar door dat wél te doen, weet je ook of je op je scherm naar fraaie onzin zit te kijken, of naar een goed werkend model van de werkelijkheid.” Wat na statistisch wegen een gen met een grote rol lijkt, kan in experimenten immers een meetfout blijken. “Het eindresultaat is prachtig: we hebben het complex van actieve genen goed kunnen verfijnen. De nieuwe inzichten leveren een beter begrip op van hoe het immuunsysteem werkt. Dat geeft niet alleen mogelijkheden om nieuwe vaccins te ontwikkelen, maar ook meer begrip van de erfelijke basis waardoor sommige mensen vatbaarder zijn voor virusinfecties dan anderen.”

