Als medicijnen op de verkeerde plek actief zijn kunnen ze bijwerkingen veroorzaken. Promovendus Mickel Hansen ontwikkelde aan- en uitschakelende medicijnen, die deze bijwerkingen verminderen en resistentie van bacteriën voorkomen.
Medicijnen maken ons leven een heel stuk beter, maar hebben soms ook vervelende kanten. Zo zorgen actieve antibiotica in het milieu ervoor dat bacteriën resistentie ontwikkelen en wij steeds minder ziektes goed kunnen bestrijden. En de medicijnen die we gebruiken voor chemotherapie richten ook veel schade aan in je gezonde cellen. Daarom proberen onderzoekers in Groningen deze medicijnen uit te rusten met een schakelaar die reageert op licht. Zo ook Mickel Hansen, die op 14 december promoveerde op dit onderwerp.
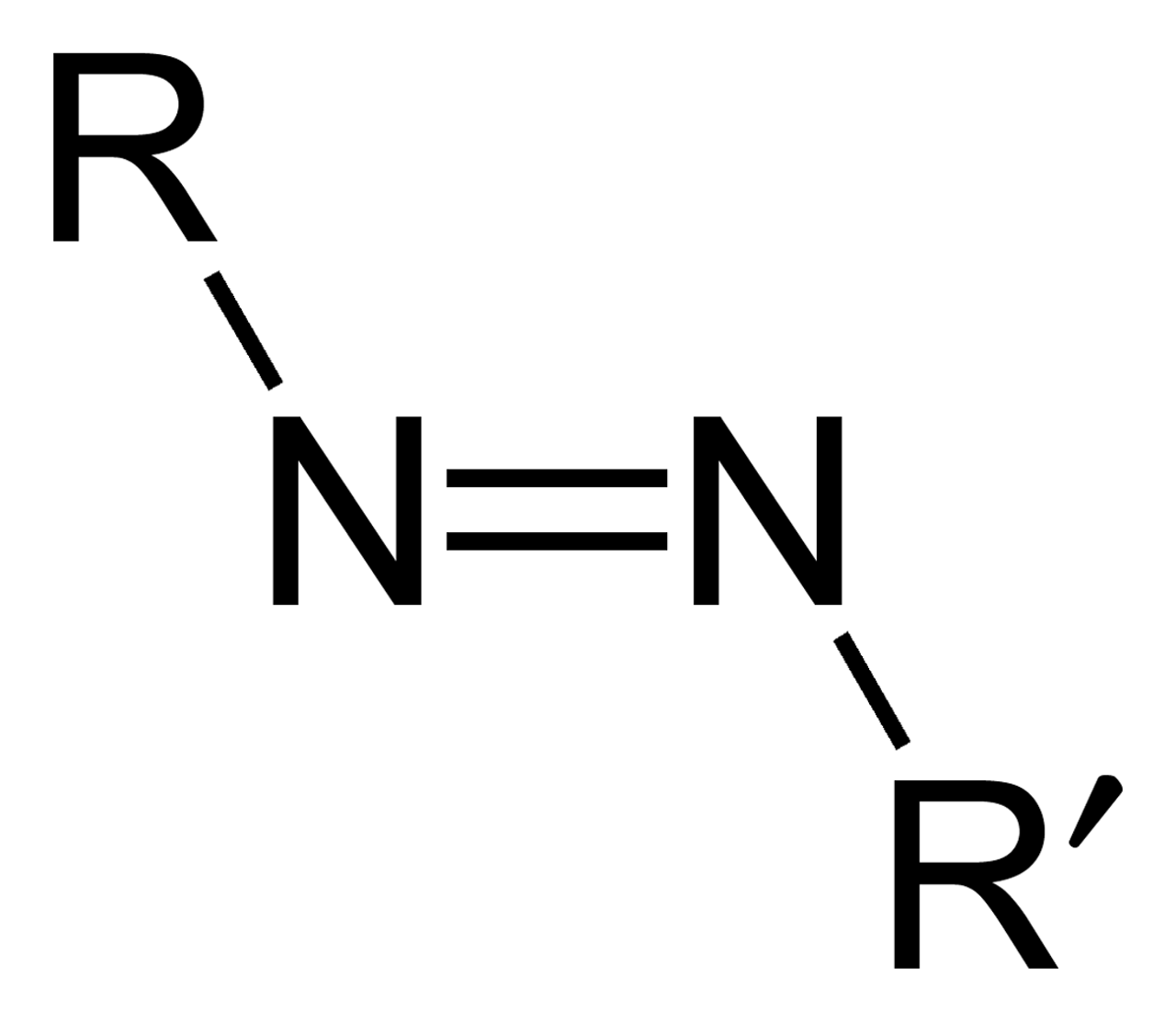
Zo ziet een azoverbinding eruit: in het midden twee stikstofatomen (=N) en daaraan kun je allerlei groepen (=R) vastmaken die in een tegengestelde richting staan (trans) of allebei dezelfde kant op (cis).
Wikimedia Commons, Benjah-bmm27 via publiek domeinVerschil maken
In de groep van Ben Feringa, die in 2016 de Nobelprijs voor Scheikunde won, aan de Rijksuniversiteit Groningen houden ze zich al langer bezig met schakelaars voor allerlei toepassingen, zoals slimme materialen of controle over chemische reacties. “In dit onderzoek richten we ons heel bewust op medicijnen”, vertelt Hansen. “Bacteriën ontwikkelen bijvoorbeeld steeds vaker resistentie tegen onze antibiotica. Dat is echt een probleem, en we denken met onze schakelaars verschil te maken.”
Om te zorgen dat er minder actieve antibiotica in het milieu terecht komen verbouwde Hansen het bestaande antibioticum trimethoprim. Hij voegde een azoverbinding toe, een verbinding met twee stikstofatomen die onder invloed van licht omklappen. “Je begint met de zogenoemde ‘trans’-vorm, waarin de twee molecuuldelen aan de stikstofverbinding tegenovergestelde kanten op gericht zijn”, legt Hansen uit. “In deze vorm werkt het medicijn niet.” Maar als de onderzoekers rood licht op het molecuul schijnen, klapt één kant om en activeert het medicijn.
Terugval
Na een tijdje valt het molecuul vanzelf weer terug naar de inactieve vorm. Hoe lang dit duurt, stemmen de onderzoekers af door extra verbindingen aan het molecuul te zetten of juist eraf te halen. “We maken nu antibiotica die een paar minuten actief blijven, maar ook versies die een paar uur actief blijven”, vertelt Hansen. “Ideaal willen we dat ze in zes uur hun activiteit verliezen, want zo lang blijft een antibioticum gemiddeld in je lichaam.”
In het lab lijkt het bewerkte antibioticum goed te werken, maar de echte test moet volgens Hansen nog komen. De onderzoekers werken samen met biologen in Groningen om te kijken wat het effect is van de aangepaste antibiotica op het milieu. “Schakelt echt alles uit, of blijven er nog genoeg moleculen actief waarvan bacteriën resistent worden? Dat is een belangrijke vraag die we moeten beantwoorden voor we verder gaan, maar het kost tijd om het antwoord te vinden.”
Zichtbaar licht
Het idee is dat je het medicijn uiteindelijk activeert door op de juiste plek in het lichaam met zichtbaar licht te stralen. Dit licht dringt namelijk al snel centimeters door in je huid, dieper dan bijvoorbeeld UV-licht. Maar dat is toch niet diep genoeg om alle infecties te bestrijden? Die vraag hoort Hansen vaker, lacht hij: “Veel mensen weten niet dat het geen enkel probleem is om licht diep in het lichaam te krijgen. We werken samen met het Universitair Medisch Centrum Groningen, waar chirurgen met minuscule incisies of zelfs een naaldenprik optische vezels in je lichaam kunnen brengen. Alleen in de schedel is nog lastig, want dan moet je boren, en ook beenmerg is moeilijk te bereiken.”
Met deze techniek wil Hansen niet alleen infecties bestrijden, hij ontwikkelde ook ook een manier om een bestaand kankermedicijn minder bijwerkingen te geven. “Kankermedicijnen vallen veel gezonde cellen aan op weg naar de tumor en dat geeft vaak veel problemen”, legt de chemicus uit. “Met een schakelaar zorgen wij dat het medicijn uit staat en geen schade aan kan richten.”
Blokkeren
Om het medicijn uit te schakelen, blokkeert Hansen het actieve deel van het medicijn met zogenaamde beschermgroep, een verbinding die niet met zijn omgeving reageert. Zodra het medicijn op de juiste plek zit, schijn je met zichtbaar licht op de tumor en valt die beschermgroep er weer af. Het medicijn kan dan de tumor aanvallen. “We moesten natuurlijk opletten dat de beschermgroep die eraf valt niet met het lichaam kan reageren, daarom gebruiken we daarvoor een redelijk inactief molecuul”, zegt Hansen. De reactie is deze keer wel onomkeerbaar, dus eenmaal aangezet kun je het medicijn niet meer uitschakelen. Hansen: “Het is een veel simpeler systeem dan de antibiotica-schakelaar, de aanpassingen op het bestaande medicijn zijn heel makkelijk. Ik denk dat we dit vrij snel kunnen implementeren.”
Of artsen deze schakelende medicijnen binnenkort echt voor gaan schrijven, blijft nog even afwachten. De onderzoekers bekijken in ieder geval of ze het kankermedicijn een boost kunnen geven in een start-up. Toch blijft Hansen reëel: “Medicijnenonderzoek duurt altijd lang en kost veel inspanningen. We moeten bijvoorbeeld nog veel toxiciteitsstudies doen om te kijken of het medicijn veilig is. Die zijn nou eenmaal nodig. Wel denk ik dat wij het makkelijker hebben omdat we bestaande medicijnen hebben gebruikt. Het zou heel gaaf zijn als onze medicijnen uiteindelijk echt mensen kunnen helpen.”

