Soms kun je veel leren van datgene dat je wilt bestrijden. Virussen zijn een goed voorbeeld. Amerikaanse onderzoekers publiceren in Nature hoe ze de verspreidingstactiek van virussen kopiëren om daarmee op een nieuwe manier nuttige stoffen in het lichaam te verspreiden.
Virussen veroorzaken vaak veel ellende bij de mensen, dieren en planten die ze infecteren. En dat doen ze op een, voor hen, ongelooflijk handige en efficiënte manier. Ze kapen als het ware de geïnfecteerde cel en gebruiken de aanwezige ‘machines’ en processen om zichzelf te vermenigvuldigen. Bovendien krijgen ze de cel zover dat deze de virusdeeltjes verpakt en lanceert om zo weer andere cellen te infecteren.
De werkwijze van virussen levert niet alleen aanknopingspunten om ze te bestrijden, maar ook ideeën voor heel andere toepassingen. Bijvoorbeeld om heel gericht geneesmiddelen in het lichaam te verspreiden. In Nature beschrijven onderzoekers van de universiteiten van Utah en Washington (beide in de Verenigde Staten) hoe ze eiwitten in een cel kunnen laten verpakken en vervolgens laten afscheiden, zodat de eiwitten in een andere cel terechtkomen. Precies zoals virussen dat doen, maar dan met – hopelijk – gunstige gevolgen. Bijvoorbeeld doordat je op deze manier ontbrekende eiwitten naar een cel kunt brengen en zo bepaalde ziekten kunt behandelen.
HIV
“We zien virussen niet langer alleen als ziekteverwekkers, maar ook als een bron van inspiratie voor nieuwe technieken”, zegt onderzoeksleider Wesley Sundquist, hoogleraar biochemie aan de universiteit van Utah, in het begeleidende persbericht. Zijn groep onderzoekt al jaren HIV, het virus dat AIDS veroorzaakt. Ze bestuderen vooral het mechanisme waarmee dit virus zich zo efficiënt door het menselijk lichaam verspreidt. Die kennis hebben ze nu gecombineerd met de expertise van de groep van Neil King aan het Institute for Protein Design van de universiteit van Washington. Eerder dit jaar beschreef NEMO Kennislink de uit eiwitten opgebouwde, zelf-assemblerende ‘nanovoetballen’ van deze groep. Deze nanovoetballen, of beter: nanokooitjes, zijn hol en kunnen ladingen vervoeren, zoals andere eiwitten of therapeutische moleculen.
Aan het genetische materiaal dat de instructies voor het bouwen van de nanokooitjes bevat, hebben de samenwerkende groepen twee andere sets instructies toegevoegd. De ene set zorgt ervoor dat bepaalde enzymen in de cel een vettige ‘staart’ aan het kooitje binden, waardoor dit zich in de celmembraan kan nestelen. De andere set mobiliseert het ESCRT-systeem (spreek uit: escort) van de cel. Een toepasselijke naam, want dit transportsysteem vormt een uitstulping in de celmembraan die vervolgens als apart belletje vrijkomt buiten de cel.
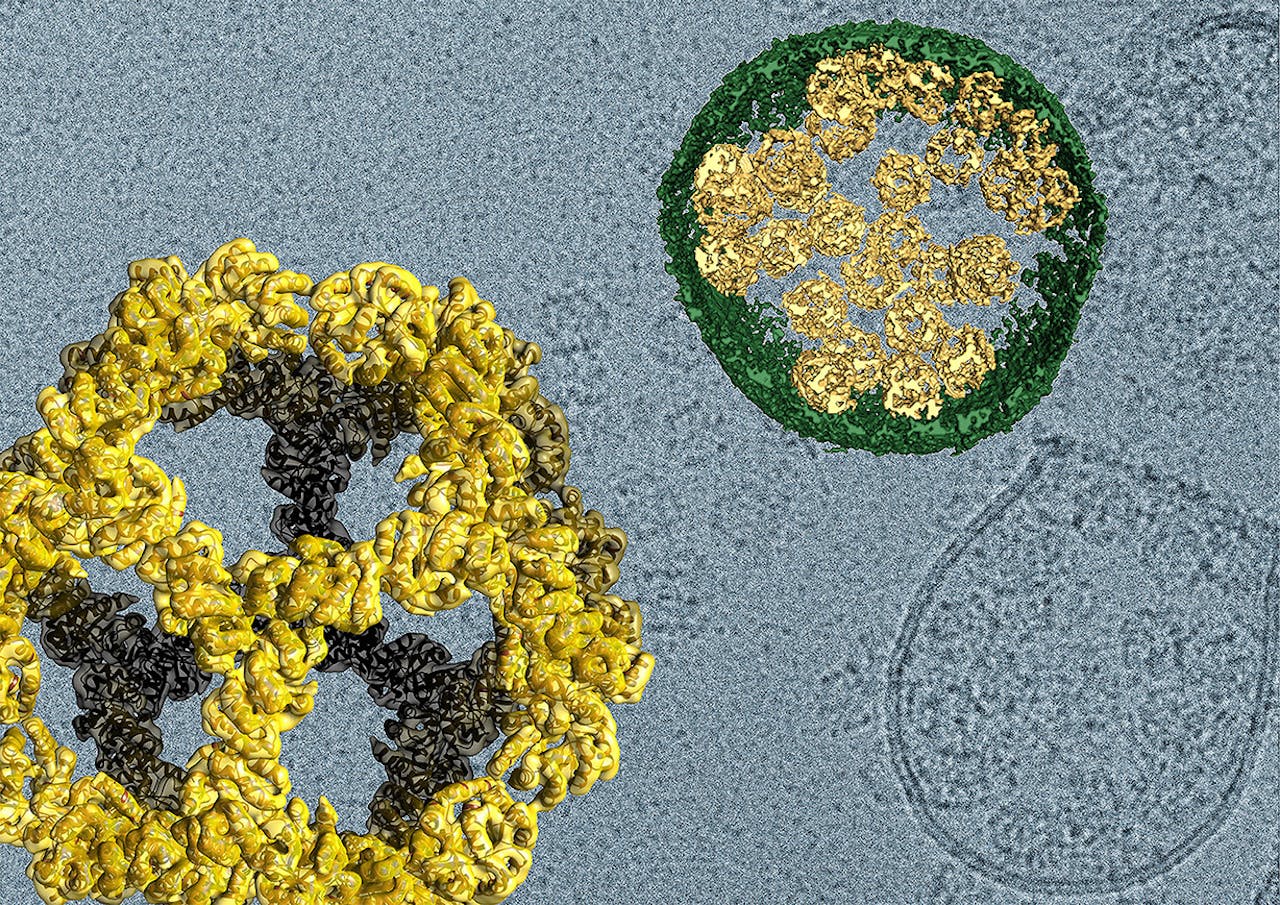
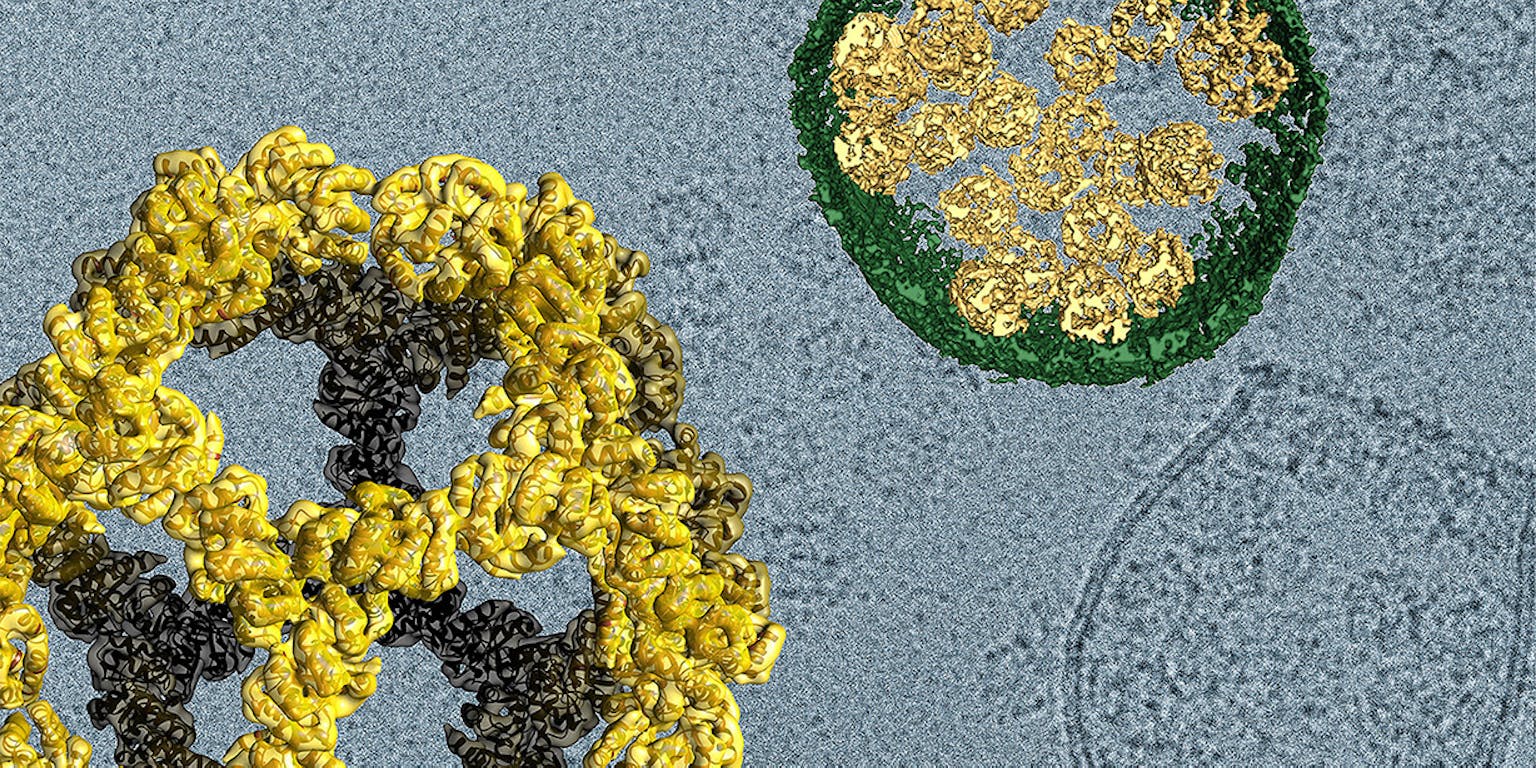
Impressie van het virus-geïnspireerde systeem. Linksonder een zelf-assemblerende nanokooi, rechtsboven een dwarsdoorsnede van een door de cel afgescheiden belletje. Omringd door een membraan (groen) kunnen zich zo meerdere nanokooitjes (goud) verplaatsen.
David Belnap, Jörg Votteler via EurekAlert.orgElegante combinatie
Door de drie onderdelen te combineren ontstaat een nieuw eiwit, EPN-01, dat zelf een hol nanokooitje vormt en zich daarna met andere nanokooitjes in een membraan laat verpakken, waardoor ze de cel kunnen verlaten. “Het combineren van de drie functionaliteiten in een doorlopend stuk genetisch materiaal vind ik heel elegant”, reageert Jan van Hest, hoogleraar Bio-Organische Chemie aan de Technische Universiteit Eindhoven desgevraagd. “Maar ik vind dit resultaat vooral mooi omdat de onderzoekers laten zien dat je met die zelf-assemblerende nanokooitjes echt iets kunt doen.”
Dat tonen de auteurs aan door in de kooitjes een detectie-eiwit mee te verpakken en bovendien te zorgen dat er ook een fusie-eiwit meegaat in het belletje dat de cel verlaat. Het fusie-eiwit zorgt ervoor dat er een koppeling ontstaat tussen het belletje en de celmembraan van een andere cel, waardoor de inhoud vrijkomt in die cel. Het detectie-eiwit bereikt inderdaad andere cellen, zo laat de publicatie zien. Dat biedt de belofte dat ook nuttige eiwitten of andere therapeutische stoffen op deze manier vervoerd en afgeleverd kunnen worden.
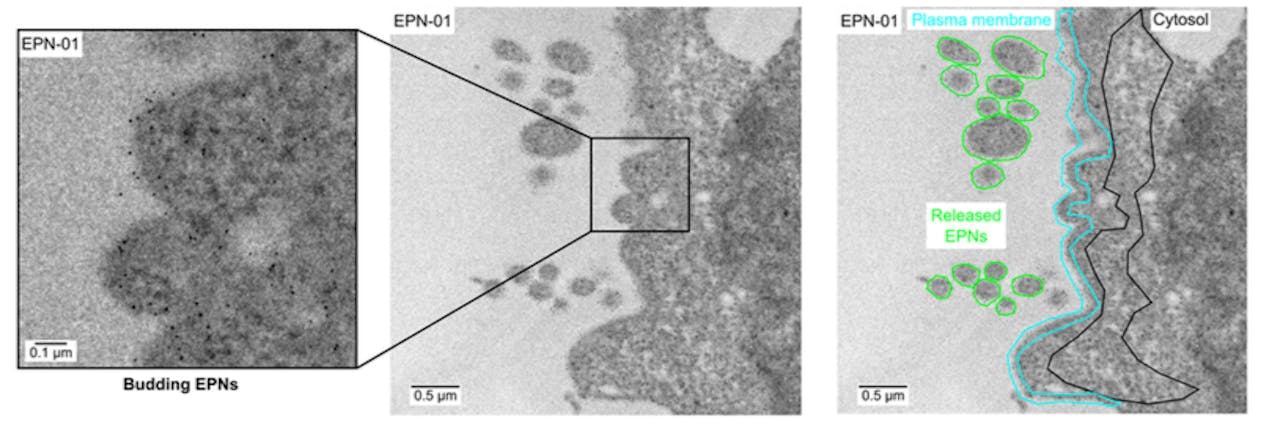
Doorsnede van de cellen waarin het nieuwe, driedelige eiwit (EPN-01) tot expressie komt. De twee linkerfoto’s zijn uitvergrotingen van een deel van de rechterfoto. Hier zijn twee ‘knoppen’ in wording te zien, die zich gaan vrijmaken uit de celmembraan.
J. Votteler, et al., Nature (2016), doi:10.1038/nature20607 (uitsnede) CC1.0Onvermijdelijke variatie
In de vrijkomende belletjes zitten meerdere nanokooitjes. Hoe kan dat als ieder kooitje z’n eigen lanceerdomein bevat? Van Hest: “Ik wil het geen toeval noemen, maar het is wel heel lastig om te sturen hoeveel er bij elkaar komen in zo’n afgescheiden belletje. Aan ieder nanokooitje worden meerdere staarten gekoppeld en als er meerdere kooitjes bij elkaar in de buurt zijn, zullen die staarten aan elkaar gaan plakken. Ik denk dat er daardoor verschillende kooitjes bij elkaar komen te zitten in de celmembraan en dan gezamenlijk worden verpakt en uitgescheiden.” Behoorlijke variatie in de inhoud van al die afgescheiden belletjes is dus onvermijdelijk.
Is dat niet vreemd voor een methode waarvan het uiteindelijke doel is om medicijnen in het lichaam heel gericht af te leveren? “Dat klopt”, zegt Van Hest. “En dit is een probleem dat speelt in al het nanogeneeskunde onderzoek. Het is heel lastig om precies te reguleren hoeveel lading je krijgt in iedere nanoreactor of nanokooi. Ook voor de reproduceerbaarheid van dit type onderzoek vormt dat een groot probleem.” Zeker waar het gaat om het ontwikkelen van methoden die je in mensen wilt toepassen, is het essentieel dat andere onderzoekers dezelfde resultaten kunnen laten zien. Zodat er geen twijfel bestaat over de veiligheid en de werkzaamheid.
Ook het rendement roept nog vragen op. Van de in de cel gevormde nanokooitjes slaagt 13 procent erin de cel ook echt te verlaten. Dat klinkt nogal beperkt, maar dat vindt Van Hest niet. “Nee hoor, dat is een percentage waar ze wat mij betreft heel tevreden mee mogen zijn. Het is hoog genoeg om te onderbouwen dat dit concept echt werkt en dit is ook nog maar het begin. Er is ongetwijfeld winst te behalen door gerichte verbeteringen. Het is wel interessant om te zien in hoeverre deze techniek het beter doet dan de al bestaande methode met exosomen; de belletjes die cellen zelf vormen om stoffen uit te scheiden. Maar deze virus-geïnspireerde structuur vind ik een hele stap vooruit.”