Levende cellen kletsen er op los. Kunstmatige cellen lukt dat ook steeds beter. Zeker nu chemici een manier hebben gevonden om signalen flink te versterken.
Communicatie is van levensbelang. Mensen, dieren, planten, schimmels, bacteriën – alles wat leeft, communiceert. Met soortgenoten of met andere levensvormen. Vriendelijk of vijandig. Bewust of onbewust – het houdt ons in leven. Zonder communicatie zouden meercelligen, zoals wijzelf, niet bestaan. De cellen in ons lichaam staan doorlopend met elkaar in contact. Ze wisselen informatie uit via chemische signalen – stoffen die een bepaald effect geven, waardoor een cel ‘weet’ wat er moet gebeuren. Dankzij die onderlinge signalen vormen verschillende cellen samen weefsels en organen die op de juiste manier functioneren. En daardoor kan ons lichaam als geheel weer functioneren. Chemische communicatie vormt zo de basis van ons leven.
De manier waarop cellen signalen uitsturen, doorgeven en verwerken is een belangrijke inspiratiebron voor onderzoekers die bijvoorbeeld werken aan kunstmatige weefsels of organen. Of aan nieuwe materialen die hun eigenschappen veranderen onder invloed van signalen van buitenaf. Denk aan materialen die de aanwezigheid van een bepaalde stof detecteren of reageren op temperatuursveranderingen. Natuurlijke materialen hebben allerlei van dit soort eigenschappen en die worden aangestuurd door communicatie tussen cellen. Daarom proberen onderzoekers het natuurlijke communicatieproces na te bootsen in synthetische cellen – in het lab gemaakte structuren die kenmerken van levende cellen hebben.
Lawine
Dat heeft inmiddels al geleid tot een collectie van verschillende synthetische cellen die signalen uitwisselen en omzetten in een reactie. Maar die communicatie lijkt nog niet echt op het natuurlijke voorbeeld, zegt Jan van Hest, hoogleraar bio-organische chemie aan de Technische Universiteit Eindhoven. “Wat we tot nu toe zien in synthetische cellen is één-op-één communicatie. Eén inkomend signaalmolecuul zorgt voor één responsmolecuul. Dat is niet heel efficiënt, zeker niet als je een snelle respons wil. In de natuur gaat dat slimmer door middel van signaalversterking. Eén molecuul dat bindt aan het oppervlak van de cel zet in de cel een hele cascade aan reacties in werking die een veelvoud aan nieuwe signalen oplevert. Dat zorgt voor een soort lawine, waardoor je met een klein signaal snel een groot effect krijgt.”
Van Hest en zijn promovendus Bastiaan Buddingh’ laten nu zien dat je ook in synthetische cellen zo’n sneeuwbaleffect kunt opwekken. Ze maakten gebruiken van een bestaand type synthetische cel, de zogeheten Giant Unilamellar Vesicle (GUV). Dit zijn relatief grote waterbelletjes met een vettig buitenlaagje die zichzelf vormen. In het buitenlaagje verwerkten ze een eiwit dat een porie vormt, een opening waardoor moleculen in en uit de cel kunnen. In het experiment zijn er twee soorten cellen: senders (zenders) en receivers (ontvangers). De senders bevatten enzymen – eiwitten die een chemische reactie uitvoeren – die het molecuul ATP omzetten in het kleinere AMP. De receivers bevatten drie andere enzymen die samen een cascade vormen, een set reactiestappen die elkaar opvolgen. In deze cascade wordt uiteindelijk het molecuul NADH gevormd.
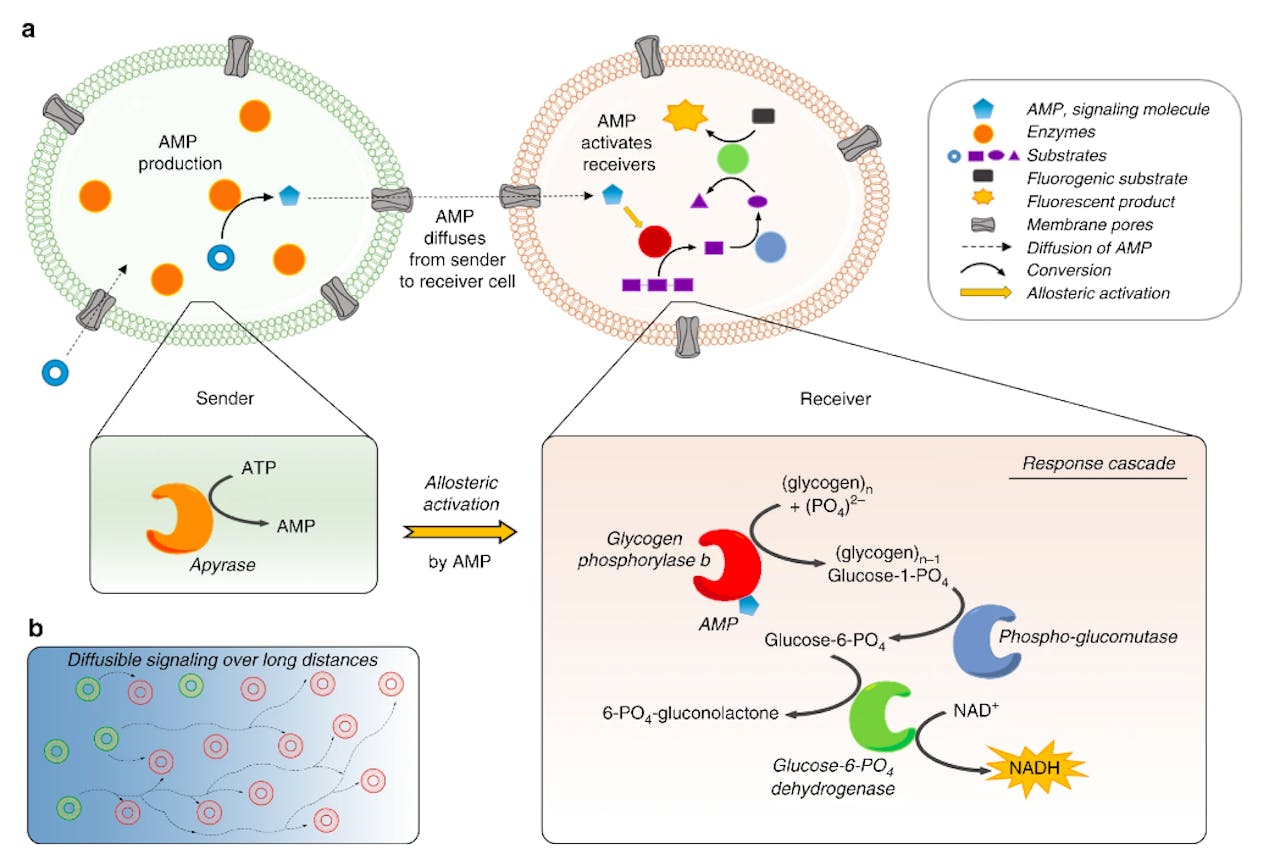
Linksboven een Sender cel, waar ATP wordt omgezet in AMP dat vervolgens de cel verlaat. Rechtsboven een Receiver cel met daarin drie enzymen die samenwerken. Zodra AMP (blauw blokje) bindt aan het enzym GPb (rood bolletje) treedt een versnelling op en produceert de cel heel efficiënt NADH (gele ster). Binding van een molecuul AMP zorgt voor de productie van tien moleculen NADH.
Buddingh' et al, Nature Communications (2020)De communicatie verloopt als volgt. ATP komt binnen bij een sender, wordt omgezet in AMP en verlaat de sender weer. Via de oplossing waarin de cellen ronddobberen, bereikt AMP een receiver, gaat naar binnen en bindt aan het eerste enzym uit de cascade. Dit enzym, GPb, heeft twee ‘standen’: lage of hoge activiteit. Zodra het AMP eraan plakt, schiet GPb in de hoge activiteit-stand en zet de cascade in werking, waardoor er heel snel heel veel NADH wordt gemaakt. “Daar zit de signaalversterking in”, legt Van Hest uit. “Eén gebonden AMP molecuul levert een opbrengst van tien NADH moleculen. Door een molecuul te gebruiken dat het enzym activeert, krijg je een enorme versterking van het signaal. NADH is bovendien een molecuul dat in allerlei biologische processen een rol speelt, dus je kan hiermee nog weer een veelvoud aan andere reacties in gang zetten.”
Collectief gedrag
Dankzij die versterking kan het signaal ook over grote afstand tot een effect leiden. “Zodra een klein molecuul, zoals AMP, een cel verlaat kan het overal heen. Je krijgt dus een enorme verdunning van je signaal. Maar wij zien in ons systeem dat het signaal ook op grote afstand nog een effect heeft. Het kan wel tot tweehonderd keer de lengte van een cel afleggen en dan nog zien we productie van NADH.”
Dat ‘zien’ kun je hier letterlijk nemen. Van Hest: “We hebben de cellen in een soort kanaal geplaatst, met aan een kant de senders en de receivers verderop. Aan de kant van de sender hebben we ATP toegevoegd, dus het signaal komt van één kant. Omdat NADH van nature fluorescerend is, het geeft een blauw licht, konden we het verloop van het proces mooi volgen. We zagen een front van blauw licht door het kanaal gaan en dat bereikte ook de receivers die ver weg waren.”
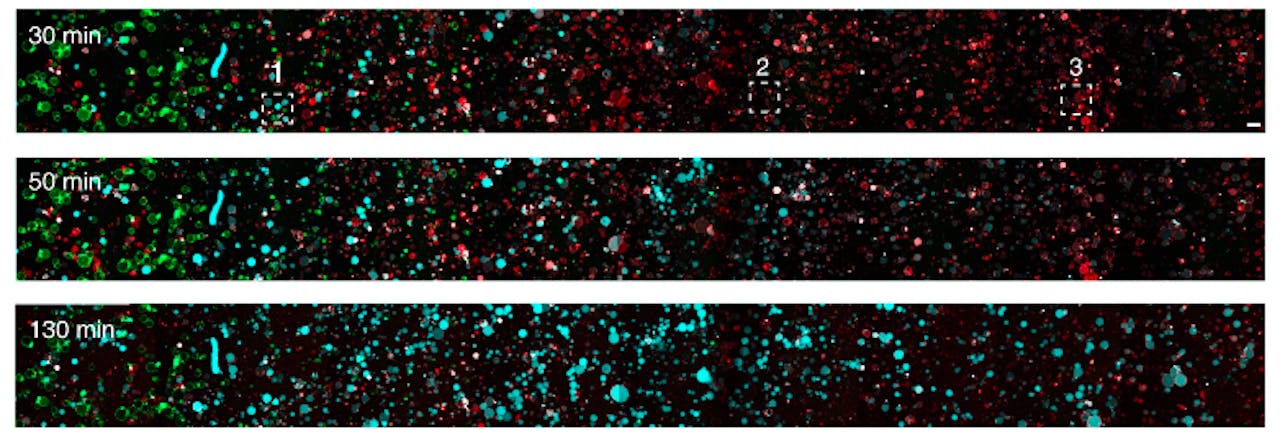
Opnames van het ‘kanaal’ met daarin de Senders (groen) en Receivers (rood). Receivers die zijn geactiveerd en NADH produceren, lichten blauw op. Na verloop van tijd produceren ook de meest veraf gelegen Receivers NADH.
Buddingh' et al, Nature Communications (2020)Ingewikkeld samenspel van reacties
Maar wat kun je hier verder mee bereiken? Communicatie is een middel, geen doel op zich. “Een van onze plannen is om via deze communicatieroutes het gedrag van cellen te sturen. Bijvoorbeeld dat de cellen in respons op een signaal tot elkaar aangetrokken worden en een kolonie vormen, die ook weer uit elkaar valt als het signaal verdwijnt. We willen naar collectief gedrag in de cellen, dat je ze echt iets kunt laten ‘doen’ als reactie op een signaal. Een ander voorbeeld is het inbrengen van groeifactoren, waardoor je op het gewenste moment synthetische cellen laat communiceren met levende cellen om zo de vorming van nieuwe cellen in gang te zetten.”
Voor heel concrete toepassingen is het nog te vroeg, maar door steeds beter de natuurlijke processen na te bootsen, hoopt Van Hest meer inzicht te krijgen in hoe dat complexe samenspel van reacties werkt. En dat is weer nuttig om werkzame synthetische weefsels en andere ‘slimme’ materialen te maken die kunnen communiceren met hun biologische voorbeelden.

