Koolstof kan bindingen maken met maar liefst zes andere atomen. Dat bewijzen Duitse onderzoekers door een veertig jaar oud experiment te herhalen. Daarmee weerleggen ze basiskennis scheikunde uit de schoolboeken, die stelt dat maar vier bindingen mogelijk zijn.
Tijdens scheikundelessen op de middelbare school leert iedereen dat elk atoom maar een bepaald aantal bindingen aan kan gaan. Dit heeft alles te maken met de beschikbare elektronen in het atoom. Koolstof heeft vier losse elektronen, dus kun je het aan niet meer dan vier andere atomen binden. Toch wisten Duitse onderzoekers van de Vrije Universiteit van Berlijn een koolstofatoom zo ver te krijgen dat het zes bindingen maakte.
We weten al langer weten dat koolstof soms vijf bindingen aangaat, bijvoorbeeld als je het met bijvoorbeeld goud koppelt of in CH5+. Maar een koolstof die aan zes andere atomen bindt is nog nooit experimenteel aangetoond.Moritz Malischewski, een van de Duitse onderzoekers, las een publicatie van de Nederlandse chemicus Hogeveen en werd geïnspireerd om te bewijzen dat die zeswaardige koolstof echt bestaat.
Sneeuwvlok
“Al in de jaren 70 voorspelde Hogeveen dat er een molecuul bestond waarin een koolstofatoom zes bindingen had”, vertelt Malischewski. “Dit baseerde hij op zijn experimenten met het molecuuul hexamethylbenzeen.” Hexamethylbenzeen is bijna plat en ziet er een beetje uit als een sneeuwvlok. De koolstofatomen in de ring van dit molecuul hebben allemaal maar drie bindingen, maar de overgebleven elektronen zorgen voor stabiliteit door rond te springen in de ring.
In een experiment verwijderde Hogeveen twee elektronen uit de ring, wat de ring instabiel maakt. Volgens Hogeveen verandert het molecuul van structuur om stabiliteit terug te winnen. Een van de koolstofatomen wordt uit de ring gestoten en er vormt zich een soort piramide. De top van de piramide bestaat uit een koolstofatoom met maar liefst zes verbindingen.
Schoolboeken
In de veertig jaar na Hogeveens experiment isoleerde nog niemand het piramidemolecuul en kon nog niemand het goed analyseren. Dit komt doordat de experimentele details van het experiment niet duidelijk werden beschreven. Toch waagde Malischewski een poging: “Ik kreeg het molecuul uiteindelijk te pakken in een sterk zuur en bij lage temperaturen.”
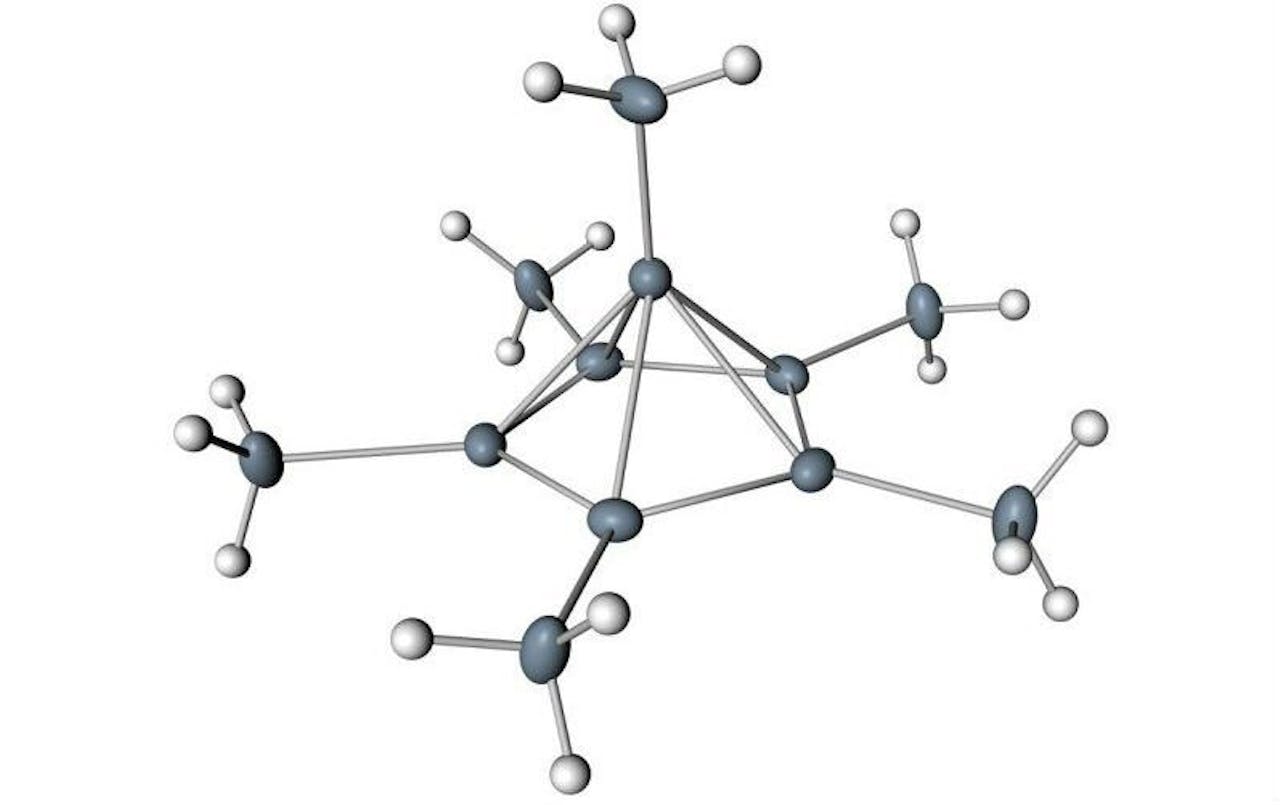
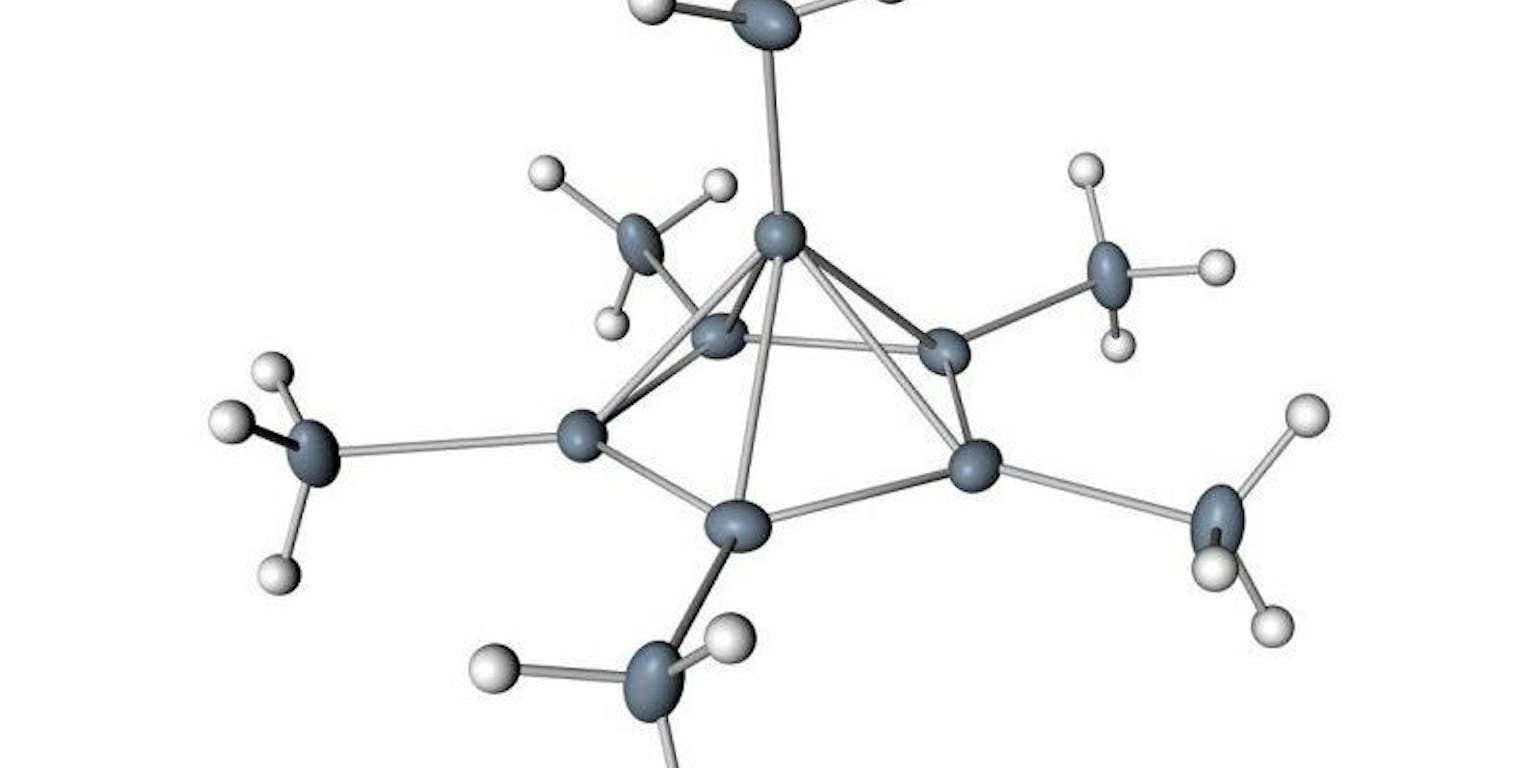
Het koolstofatoom bovenop de piramide bindt aan zes andere atomen.
Via Moritz Malischewski & Konrad SeppeltVervolgens gebruikte Malischewski X-Ray-spectroscopie om de 3D-structuur van het molecuul te bepalen. Wat Hogeveen al vermoedde bleek te kloppen: het bovenste koolstofatoom ging zes bindingen aan. Toch bleken al die bindingen zwakker dan je normaal ziet. “We hebben een formule om de sterkte van de bindingen te berekenen, en daar komt een getal uit tussen de nul tot één”, legt Malischewski uit. “Als je de uitkomst voor alle zes bindingen bij elkaar optelt, kom je uit op vier.” De zes bindingen voelen voor het koolstofatoom dus eigenlijk aan als maar vier bindingen.
Een echte toepassing zal deze kennis niet opleveren. “Het is meer een academisch en theoretisch experiment”, geeft Malischewski toe. De chemicus denkt wel dat de scheikundelessen door zijn onderzoek gaan veranderen: “Ik denk dat het zeker een voorbeeld wordt voor de schoolboeken van de toekomst. Het is zeker niet zo dat alles wat we hiervoor dachten niet klopt, maar koolstof is toch flexibeler dan we dachten.”