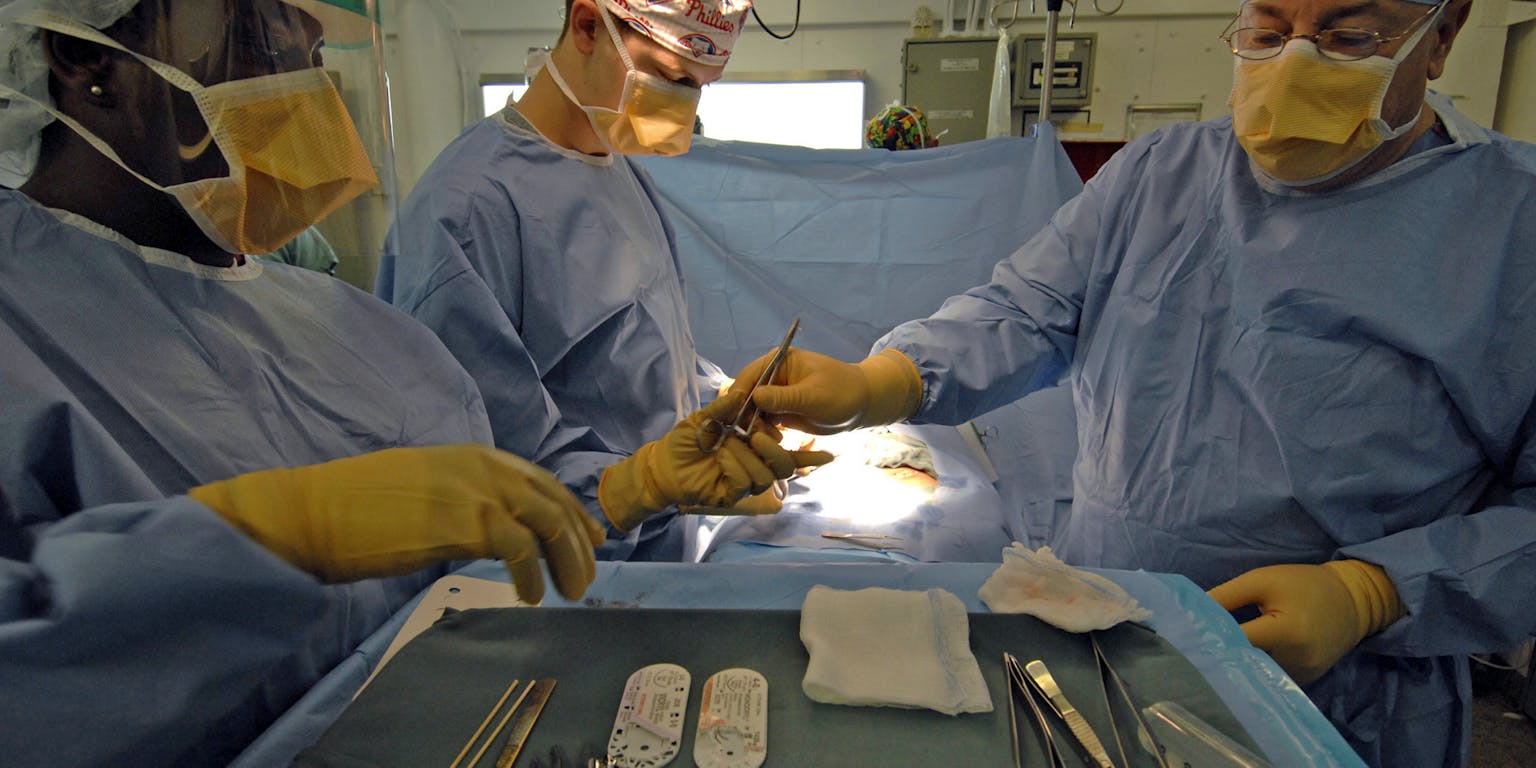
Vijf van de honderd kunstheupen, katheters en andere implantaten infecteert. Om dat aantal terug te dringen, werken wetenschappers aan strategieën om bacteriën te tackelen in hun race om het implantaat te bezetten.
Het startschot valt zodra de chirurg de kunstheup in de wond plaatst; de race is begonnen. Lichaamseigen cellen spoeden zich naar het implantaat om het materiaal te verweven met het omliggende weefsel. Maar ook bacteriën, die onvermijdelijk in de wond terechtkomen in de operatiekamer, willen het implantaat bezetten.
Voor beide partijen is het oppervlak van de kunstheup een aantrekkelijk nieuw onderkomen. Wie zal er als eerste aankomen bij de finish? Het is een strijd die bacteriën jammer genoeg nog te vaak winnen, met een infectie tot gevolg. Dan zit er niks anders op: het implantaat moet eruit en vervangen worden.
Onvoorspelbaar
Hoe het biomaterialen – materialen toegepast in het menselijk lichaam zoals implantaten en protheses – zal vergaan hangt er, kort door de bocht gezegd, van af wie de competitie wint. In 5% van gevallen zijn het de bacteriën die zegevieren. Welke patiënten de klos zijn is vooraf niet te voorspellen, al zijn er wel de bekende risicofactoren. “Mensen met diabetes, overgewicht en rokers hebben een hoger risico op een infectie, maar ook bij gezonde mensen gebeurt het”, zegt biomedisch technoloog Edward Rochford van het Universitair Medisch Centrum Groningen.
Rochford en zijn collega’s proberen de race in het voordeel van de lichaamscellen te beslechten. Hun onderzoek richt zich op manieren om kunstheupen, katheters, borstimplantaten en andere prothesen bestendig te maken tegen infectie.
Gluiperige bacteriën
Aan de voorzorgsmaatregelen ligt het niet. In de operatiekamer zijn de instrumenten steriel en voor ze beginnen schrobben de chirurgen en het assisterend personeel hun handen nauwkeurig schoon. Toch is het onvermijdelijk dat er tijdens een uren durende operatie bacteriën in de wond vallen. Geen enkel OK-pak is volledig steriel en bij het opensnijden van de patiënt gaan bacteriën op de huid mee naar binnen. Ook na de operatie is het gevaar niet geweken; bacteriën kunnen jaren later via een bacteriële infectie elders in het lichaam, zoals een longontsteking, via het bloed alsnog bij het implantaat terechtkomen.
Een biomateriaal bezet door bacteriën kan minder goed zijn plaats vinden in het omliggende weefsel. Soms raakt het weefsel zelf ook geïnfecteerd en kan het implantaat los komen te liggen en pijn veroorzaken. Een uit de hand gelopen infectie kan zelfs leiden tot de dood.
Bij tijdelijke implantaten zoals katheters komen infecties relatief vaak voor. Katheters worden door de huid geprikt en staan in contact met de buitenwereld waar bacteriën ronddwarrelen. Daar staat tegenover dat een geïnfecteerde katheter minder ernstige gevolgen heeft voor de patiënt dan een infectie op een permanente heupprothese: hij moet er toch na een tijdje uit.
Verzwakte afweerreactie
Waarom ruimt ons afweersysteem die indringers eigenlijk niet op? Ten eerste is het afweersysteem op de plek van de operatie verzwakt, waardoor het bacteriën rond die plek minder heftig aanvalt. “Daarnaast is ons lichaam minder goed in staat om bacteriën aan te pakken als er een implantaat aanwezig is”, zegt Rochford.
“We reageren met een ontstekingsreactie op materiaal dat niet in ons lijf thuishoort. Het gevolg is dat het afweersysteem zich focust op het materiaal in plaats van op het verwijderen van bacteriën.” Het feit dat het biomateriaal er ís, geeft dus een vergroot risico op infectie.
Tandplak
Een door bacteriën overwoekerde kunstheup vervangen is duur en voor de patiënt is wéér een zware operatie geen pretje. Vaak zit er niks anders op, want antibiotica kan het probleem meestal niet verhelpen. Rochford legt uit waarom de infecties zo moeilijk zijn te bestrijden.
“Bacteriën produceren net als lichaamscellen een reeks eiwitten, genaamd adhesiemoleculen, waarmee ze aan oppervlakten kunnen hechten. Eenmaal op het oppervlak aangekomen maken de bacteriën een slijmerig laagje aan waar ze met z’n allen in blijven zitten. Dat laagje, te vergelijken met tandplak op je tanden, is ondoordringbaar voor antibiotica.” Ook reacties van het afweersysteem kunnen er niet goed bij.
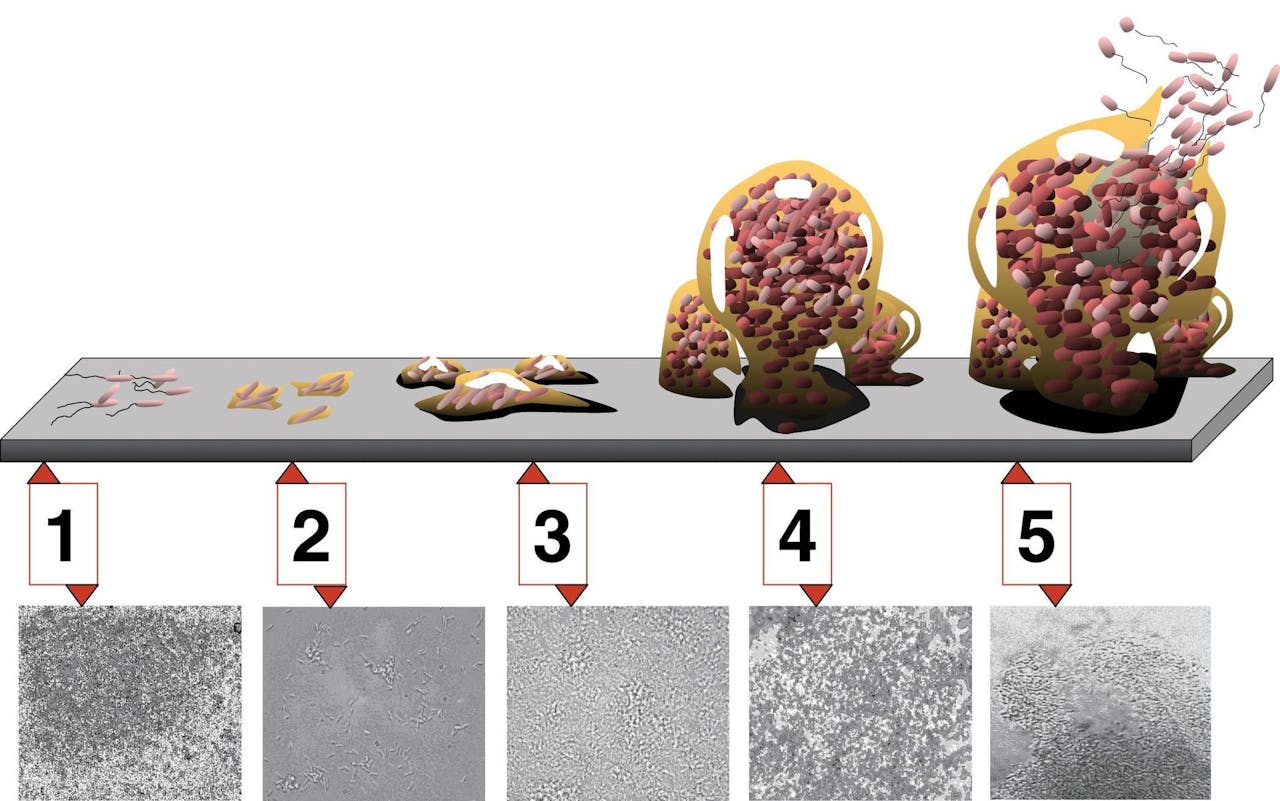
Hoe ontstaat een biofilm? Eerst hechten bacteriën zich aan het oppervlak van het materiaal (1). Ze scheiden stoffen uit waardoor ze vast blijven zitten (2) en beginnen zich in de slijmlaag te vermenigvuldigen (3). De biofilm wordt steeds dikker (4) en uiteindelijk komen sommige bacteriën los uit de laag om zich te verspreiden (5).
Wikimedia Commons/D. DavisDat laagje op het oppervlak, wat een biofilm heet, geeft lang niet altijd meteen problemen. Bacteriën kunnen jarenlang slapend doorbrengen in hun slijmlaag en zich verstoppen in het omliggende weefsel, om vervolgens te ontwaken en alsnog een infectie te veroorzaken. “Iets stimuleert hun plotselinge activiteit. Hoe dat gebeurt weten we niet precies”, peinst Rochford. Mogelijk zorgt een plotselinge verzwakking van het afweersysteem, bijvoorbeeld bij een griepje, voor die opleving van bacteriën, denkt hij. Maar dat is vooralsnog speculatie.
Tand van titanium
Het opkomende veld van de regeneratieve geneeskunde heeft tot nu toe erg weinig rekening gehouden met infecties die implantaten kunnen veroorzaken. Om het risico op infectie te begrijpen en verminderen, probeert Rochford de afweerreacties op verschillende plaatsen in het lichaam te doorgronden.
Zo zijn ze bezig met een onderzoek naar tandimplantaten van titanium. Rochford: “Titanium is de gouden standaard omdat het afweersysteem er niet zo heftig op reageert.” Naast het type materiaal speelt ook de plaats in het lichaam waar een implantaat belandt een rol bij infectie.
In de mond zijn bacteriën alom aanwezig. Tandimplantaten zijn daarom in vergelijking met andere implantaten bedekt met een grote lading bacteriën. Toch infecteren ze nauwelijks. “We denken dat het komt doordat het afweersysteem in de mond tolerant is: het lichaam richt zich op het verwijderen van de bacteriën en laat het materiaal min of meer met rust. Daarmee suggereren we dat de afweerreactie verschillend is op diverse locaties in het lichaam.”
Anti-bacterieel laagje
Naast zijn fundamentele werk is Rochford ook betrokken bij onderzoek naar multifunctionele coatings voor toepassing op biomedische implantaten. In april dit jaar publiceerde de Groningse groep een artikel in het vakblad Biomacromolecules, waarin ze een nieuwe infectie-resistente coating uit de doeken doen.
De coating bestaat uit een soort microscopisch kleine haren van polymeer die het voor bacteriën lastig maken om zich aan het oppervlak te hechten. Op de haren zitten weer eiwitten die bacteriën die ermee in contact komen doden, mochten de lastpakken toch door de haren zijn geglipt. Tot slot voorzagen ze de coating ook nog van een bepaald eiwit dat specifiek lichaamscellen aantrekt (zie filmpje hieronder).
De resultaten waren hoopgevend: in drie typen bacteriën kon de coating in het laboratorium hechting voorkomen en bacteriën doden. Met deze aanpak verwachten ze het aantal infecties in de toekomst te halveren. De finish komt in zicht.