Bij chemotherapie is het niet altijd slim om de hoogst mogelijke dosis toe te dienen. Woekerende tumorcellen evolueren onder invloed van de toegediende medicijnen, en kunnen zo resistent worden. Speltheorie helpt de oncoloog aan slimmere strategieën om de tumor de baas te blijven.
Het probleem is al zo oud als de chemotherapie zelf: in eerste instantie is het medicijn dat selectief de kankercellen doodt zeer effectief, zodat de omvang van de tumor snel afneemt, soms zo sterk dat deze niet meer detecteerbaar is.
Maar zelden zal de tumor echt verdwenen zijn. Na verloop van tijd begint deze – inclusief eventuele uitzaaiingen – weer te groeien, en nu werkt het medicijn niet meer. Dan volgt een tweede ronde chemotherapie met een ander medicijn, en dan is het vaak hetzelfde verhaal: aanvankelijk succes, waarna ook het tweede medicijn niet meer werkt. Enzovoort, zolang de patiënt de belastende chemotherapieën kan verdragen, en zolang er nog nieuwe medicijnen op de plank liggen.
Als eerste aan zet
In het vakblad JAMA Oncology bepleiten Katerina Stankova, wiskundige aan het Department of Data Science and Knowledge Engineering van de Universiteit Maastricht, en haar Amerikaanse collega’s om chemotherapie op een fundamenteel andere manier te zien: als een kat-en-muisspel tussen de behandelend oncoloog en de kankercellen.
In dit spel heeft de oncoloog een belangrijk voordeel: hij of zij is altijd als eerste aan zet, door het starten van een therapie. De kankercellen kunnen alleen maar reageren door resistentie tegen de therapie te ontwikkelen. Dit gebeurt ongeveer op dezelfde manier als bij bacteriën die resistent worden tegen een antibioticum: bij de celdeling ontstaan spontane mutaties die altijd wel een van de talloze bacteriën resistent tegen dat middel maken. De overige bacteriën sneuvelen wel en juist dankzij dit gebrek aan concurrentie kan dit ene individu zich vervolgens razendsnel vermenigvuldigen en dominant worden. Net als bacteriën delen en muteren kankercellen snel, veel sneller dan gezonde lichaamscellen.
Dit type kat-en-muisspel heet een Stackelberg-spel, en toepassingen ervan in de economie worden al sinds de jaren dertig bestudeerd. Het gaat dan vaak om twee partijen die een zo groot mogelijk aandeel in de markt voor een zeker product willen veroveren. Volgens de wiskundige analyse heeft de eerste die met het product op de markt komt een aanzienlijk en blijvend voordeel.
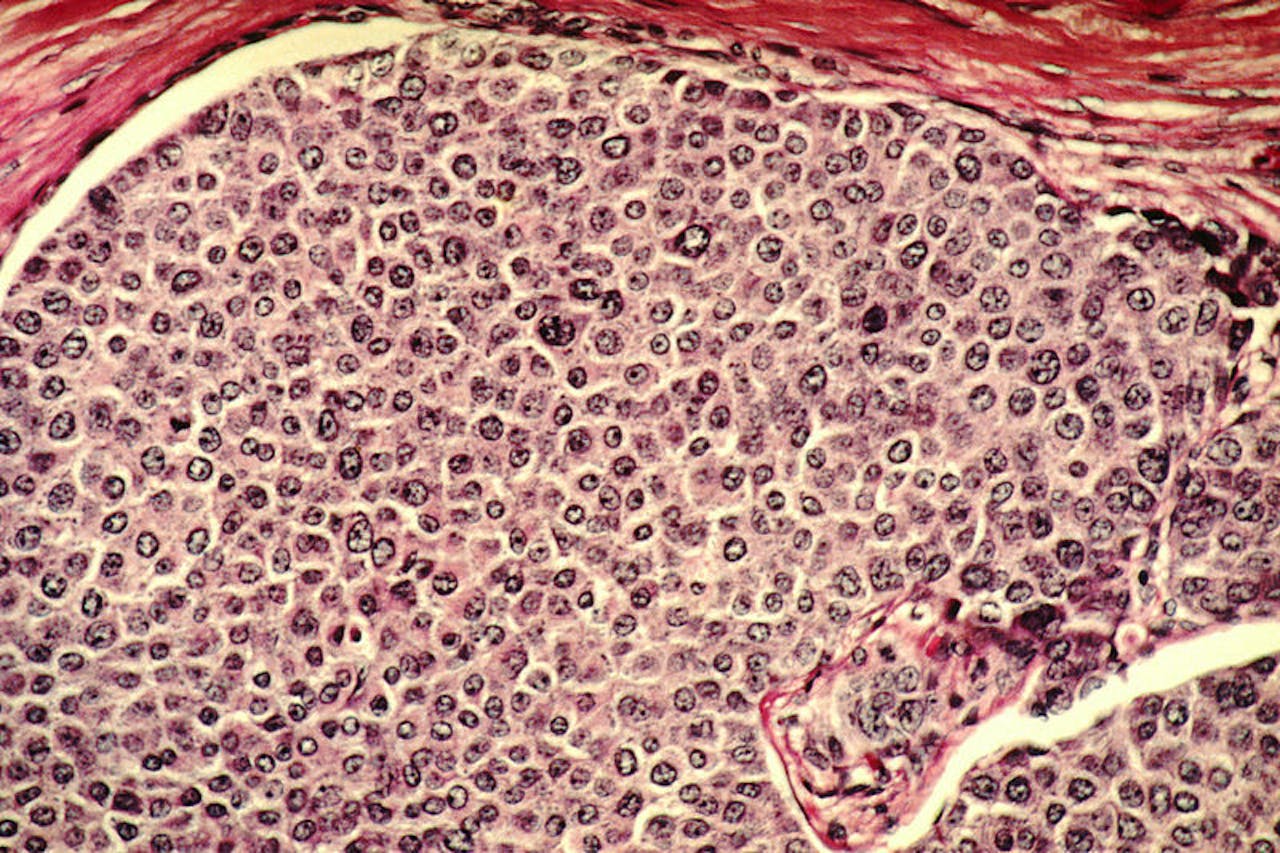
Borstkanker-cellen die gezond weefsel infiltreren.
Cecil Fox, Public DomainDe rollen omgedraaid
Maar volgens Stankova en collega’s geeft de oncoloog het voordeel van de eerste zet uit handen als hij zich houdt aan het al een halve eeuw oude standaardprotocol voor chemotherapie: het toedienen van de maximale dosis die de patiënt kan verdragen (de MTD), en dit blijven doen totdat het medicijn niet meer werkt. “Door de behandeling pas aan te passen wanneer de tumor weer gaat groeien,” zo schrijven ze, “geeft de dokter het leiderschap uit handen aan de kankercellen, en wordt het bijna onvermijdelijk dat de therapie faalt.”
Het klinkt onlogisch: als je zoveel mogelijk kankercellen wilt doden, hoe kan het dan beter zijn om de patiënt niet de MTD toe te dienen? Laten klinisch artsen, die dagelijks met patiënten werken, zich overtuigen door theoretische, wiskundige overwegingen? Stankova (per e-mail): “Twee van mijn mede-onderzoekers zijn klinisch arts, dus die zijn al ‘aan boord’. Ook heb ik hierover in januari een workshop gegeven in Leiden waarbij ook clinici bij aanwezig waren, en sommigen staan nu open voor dit idee.”
In hun artikel beschrijven Stankova en collega’s het voorbeeld van uitgezaaide prostaatkanker. In zulke tumoren zijn al meerdere soorten kankercellen aanwezig die resistent zijn tegen verschillende medicijnen.
Die verschillende types cellen zijn echter ook elkaars concurrent, want ook tumorcellen hebben zuurstof en voedingsstoffen uit het lichaam nodig. In het eerste voorbeeld in de volgende afbeelding bestaat de tumor voor 95 procent uit cellen die gevoelig zijn voor androgeen deprivatie therapie (ADT). Blijkbaar zijn deze cellen ‘fitter’ dan de twee andere types cellen, die samen maar 5 procent van de tumor vormen.
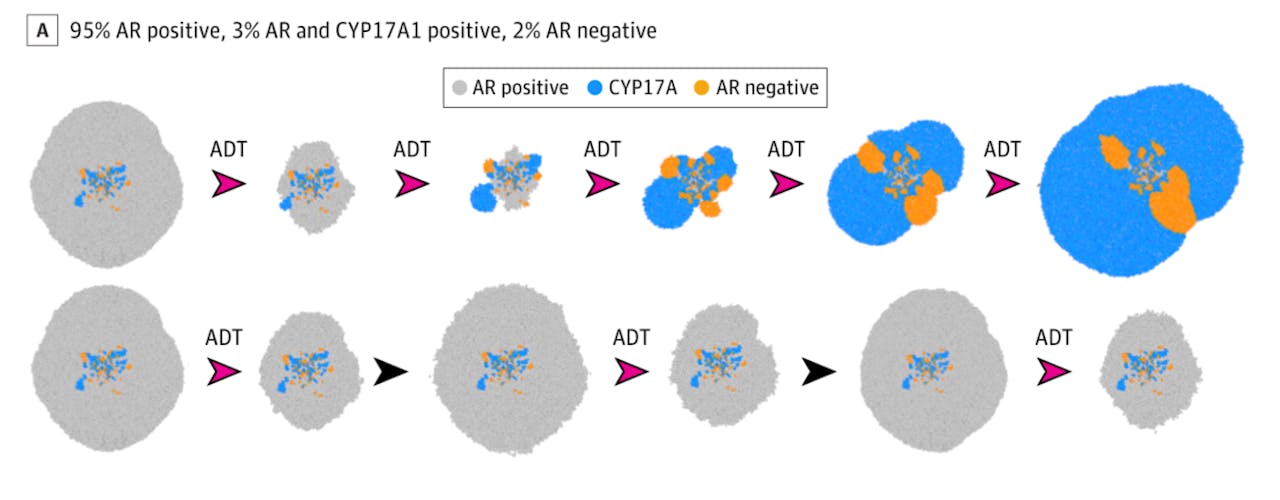
Computersimulatie van het bestrijden van prostaatkanker.
Boven: de gangbare androgeen deprivatie therapie (ADT), waarbij in opeenvolgende etappes de maximaal verdraagbare dosis van de medicijnen gegeven wordt. Dit selecteert trefzeker de tumorcellen die ADT-resistent zijn (blauw en geel), waarna die, zonder concurrentie van de op zich fittere ADT-gevoelige cellen, ongeremd kunnen gaan groeien.
Onder: Door de ADT te onderbreken als de tumor tot de helft geslonken is (zwarte pijl), blijven de ADT-resistente cellen concurrentie ondervinden van ADT-gevoelige tumorcellen, waardoor ze niet in aantal toenemen. De groei van de ADT-gevoelige cellen (grijs) is blijvend onder controle te houden door de ADT met tussenpozen te herhalen.
De oncoloog aan zet
ADT reduceert aanvankelijk dus effectief de omvang van de tumor, maar het schakelt ook de concurrentie voor de ADT-resistente cellen uit. Dit proces is te modelleren als een Stackleberg-spel, en uit computersimulaties blijkt dat het niet optimaal is om met de ADT door te gaan totdat die niet meer effectief is. In een tumor met minder ADT-gevoelige cellen (zoals in de volgende afbeelding te zien is) is volgens de computersimulaties een strategie waarbij afwisselend deze cellen en een van de types niet-ADT-gevoelige cellen bestreden wordt optimaal.
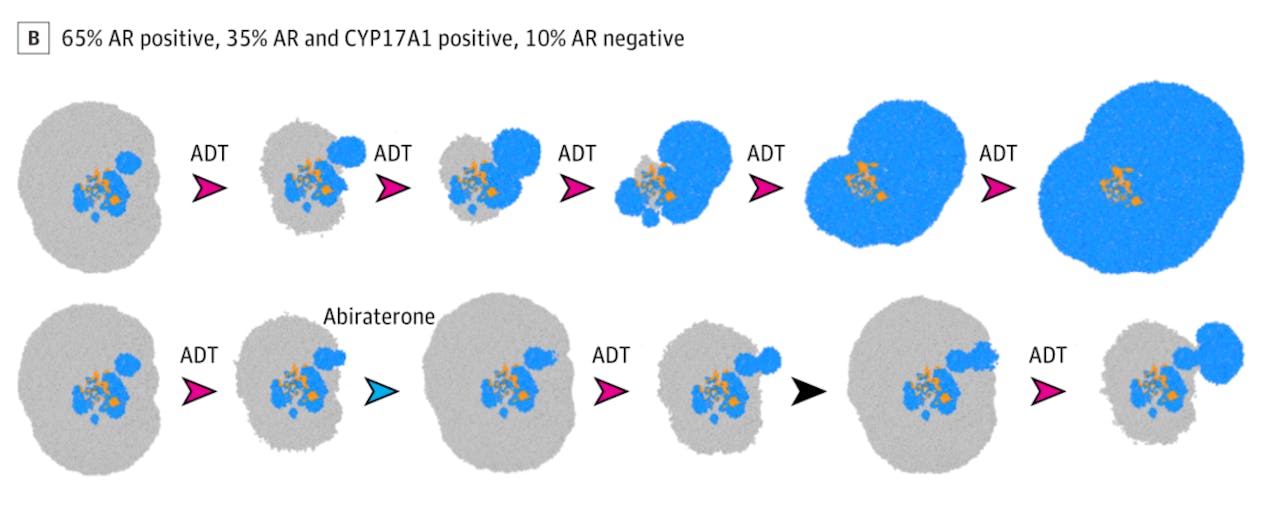
Computersimulatie van het bestrijden van prostaatkanker (2).
Boven: Vergelijkbaar met de eerder afbeelding, maar de tumor heeft een andere samenstelling. Ook hier faalt de gangbare therapie uiteindelijk.
Onder: Nu wordt ADT afgewisseld met zowel toedienen van abiraterone (om de blauwe tumorcellen te onderdrukken) als pauzes in de medicatie. Ook hier blijft de tumor beter in bedwang dan met de gangbare therapie.
Door het ‘spel’ slimmer te spelen, kan de oncoloog het gevecht met de tumor winnen of de tumor langer onder controle houden – wat ook winst is voor de patiënt, omdat die dan vaak nog een redelijke kwaliteit van leven heeft. Overigens, de oncoloog kan niet vals spelen door alle types kankercellen tegelijk maximaal te bestrijden; zo’n behandeling zou de patiënt niet overleven.
Maar dat zijn slechts computersimulaties. Zijn er ook al klinische trials (met patiënten) gedaan? Stankova: “Tot nu toe is er een succesvolle trial gedaan met uitgezaaide prostaatkanker (zie dit artikel in Nature Communications) waar de adaptieve behandeling veel beter werkte dan de maximaal verdraagbare dosis. Er worden nu meerdere trials opgestart aan het Moffit Cancer Center in Tampa, Florida, en elders in de VS. Hopelijk bereikt deze nieuwe golf ook snel Europa.”
Voordeel uitbuiten
Dit artikel in JAMA Oncology is eigenlijk nog maar de aanzet tot een heel andere manier van denken over kankertherapie die in opkomst is. Het gaat dan niet meer primair om het uitdelen van zo zwaar mogelijke klappen, maar om het voordeel van de eerste zet en het uitbuiten van de eigenschappen van de tumor. Die moeten dan natuurlijk wel bekend zijn, maar de mogelijkheden om die te bepalen, met biomarkers in het bloed en door het bepalen van celtypes, zijn de laatste jaren snel beter geworden.
Ook de reactie van de tumor op de chemotherapie geeft nuttige informatie. De onderzoekers beschrijven die eerste fase van de chemotherapie zelfs als “aftasten welke resistentie-strategieën de tumor beschikbaar heeft”. In een volgende wetenschappelijke publicatie zullen ze een meer formele, wiskundige analyse geven van de diverse spellen die de oncoloog met een tumor kan aangaan.

