Biomoleculair wetenschapper Joost Snijder is een van de winnaars van de Heineken Young Scientists Awards 2018. Hij gebruikt geavanceerde technieken om virussen beter te begrijpen.
Joost Snijder kijkt graag naar moleculen. Het liefst naar zo groot mogelijke moleculen. Denk dan aan ingewikkelde eiwitten of meerdere eiwitten die samen weer een groter geheel vormen. Zoals de biologische klok van cyanobacteriën, een project van Snijder waar NEMO Kennislink al eerder over schreef.
En het kan nog groter. Snijder heeft tijdens zijn promotieonderzoek onder meer gewerkt aan het ontwikkelen van een speciale techniek – ‘native’ massaspectrometrie – waarbij zelfs complete, intacte eiwitmantels van virussen tot in detail te bestuderen zijn.
Hij gebruikt deze en andere geavanceerde technieken om niet alleen de structuur van eiwitten op te helderen. Hij wil vooral beter begrijpen hoe bijvoorbeeld virussen of een systeem als de biologische klok precies werken. Voor zijn onderzoek krijgt Snijder een van de vier Heineken Young Scientists Awards 2018, een belangrijke aanmoedigingsprijs voor jonge wetenschappers.
De meeste onderzoekers specialiseren zich in één techniek en kunnen daar hun hele loopbaan aan werken. De jury is in onder de indruk van de manier waarop jij verschillende, geavanceerde technieken, waaronder massaspectrometrie en elektronenmicroscopie, in je onderzoek combineert. Waarom kies jij voor de combinatie?
“Er zijn veel mooie technieken om de structuur van moleculen te bestuderen, maar iedere techniek heeft ook blinde vlekken. Als je dus verschillende technieken combineert, krijgt je een veel completer en grondiger beeld van de structuur. Daarom heb ik voor die aanpak gekozen. Bovendien vind ik het technische aspect van al die methoden ontzettend leuk om mee bezig te zijn. Onderzoekers kunnen er weleens blasé doen, alsof het allemaal zo gewoon is. Maar als je even stilstaat bij wat er precies gebeurt in zo’n apparaat, dat is echt indrukwekkend.”
Is de technieker boeiender dan de eiwitten die je onderzoekt?
“Nee, dat niet. Werken met deze technieken is ook interessant door de biologische onderwerpen die je ermee onderzoekt. Ik vind die afwisseling heel fijn: je bent bezig met technische én biologische vraagstukken. Bovendien kun je aan veel verschillende onderwerpen werken en dat heb ik ook gedaan, maar inmiddels is het onderzoek naar virussen toch wel mijn hoofdthema aan het worden.”
Jouw promotieonderzoek draaide om massaspectrometrie, een techniek die al lang bestaat. Waar zat het nieuwe aspect in?
“Ik heb me vooral beziggehouden met een nieuwe toepassing die we ‘native’ massaspectrometrie noemen. Met deze techniek kunnen we heel grote complexen van veel eiwitten, zoals complete virusmantels, in hun geheel bestuderen. Daardoor krijg je een zo natuurgetrouw mogelijk beeld en dat is belangrijk om goed te begrijpen hoe zo’n geheel precies is opgebouwd en hoe het functioneert. Het nieuwe van deze techniek is dat de complexen die je bestudeert echt vele malen, tot wel 100.000 keer groter zijn, dan de moleculen die je normaal gesproken met massaspectrometrie kunt analyseren. Voorheen moest je grote complexen eerst in stukken hakken, daar meting aan verrichten en dan de boel weer in elkaar puzzelen. Dan gaat er altijd een deel van de informatie verloren. We willen het liefst zien hoe zoiets groots er ‘in het echt’ uitziet. Maar het vraagt heel veel aanpassingen in de bestaande apparatuur om zo’n grote stap te zetten, omdat de apparaten die dit zouden kunnen er nog niet zijn. Zo nieuw is het. In dit soort onderzoek werk je daarom ook heel nauw samen met de bedrijven die massaspectrometers bouwen. Voor hen is dit ook compleet nieuw.”
Wat waren de belangrijkste obstakels waar je tegenaan liep?
“Het was heel moeilijk om ervoor te zorgen dat die grote complexen onderweg naar de detector intact bleven. Het kan makkelijk ergens tegenaan botsen en bovendien maakt massaspectrometrie gebruik van elektrische lading die je op het molecuul aanbrengt. Die extra lading oefent veel kracht uit op het molecuul omdat die positieve en negatieve ladingen elkaar natuurlijk aantrekken of afstoten. Door te spelen met de druk van het gas in het apparaat lukte het om te zorgen voor een goede koeling van de moleculen. Want hoe kouder, hoe minder trillingen en dus hoe kleiner de kans dat de boel uit elkaar valt. Dat klinkt eenvoudig, maar het was veel werk om dit voor elkaar te krijgen in het apparaat.”
Je studeerde biomoleculaire wetenschappen. Waarom koos je voor zo’n technische specialisatie?
“Tijdens een college hoorde ik over de eiwitten die de biologische klok vormen in cyanobacteriën en over de technieken die je daarvoor nodig hebt. Dit was onderzoek uit de groep van Albert Heck, hoogleraar biomoleculaire massaspectrometrie. Ik vond dat fascinerend en besloot toen dat ik daaraan wilde werken. Vandaar dat ik koos voor het onderzoek in de Heck-groep. Tijdens mijn promotie raakte ik ook betrokken bij de zelfassemblage van virussen, het proces waarbij een virus zichzelf in elkaar zet. Na mijn promotie ben ik naar de Universiteit van Washington in Seattle gegaan om meer te leren over elektronenmicroscopie en tegelijkertijd ben ik me daar nog meer gaan verdiepen in de structuur van virussen en hun rol in ziektes.”
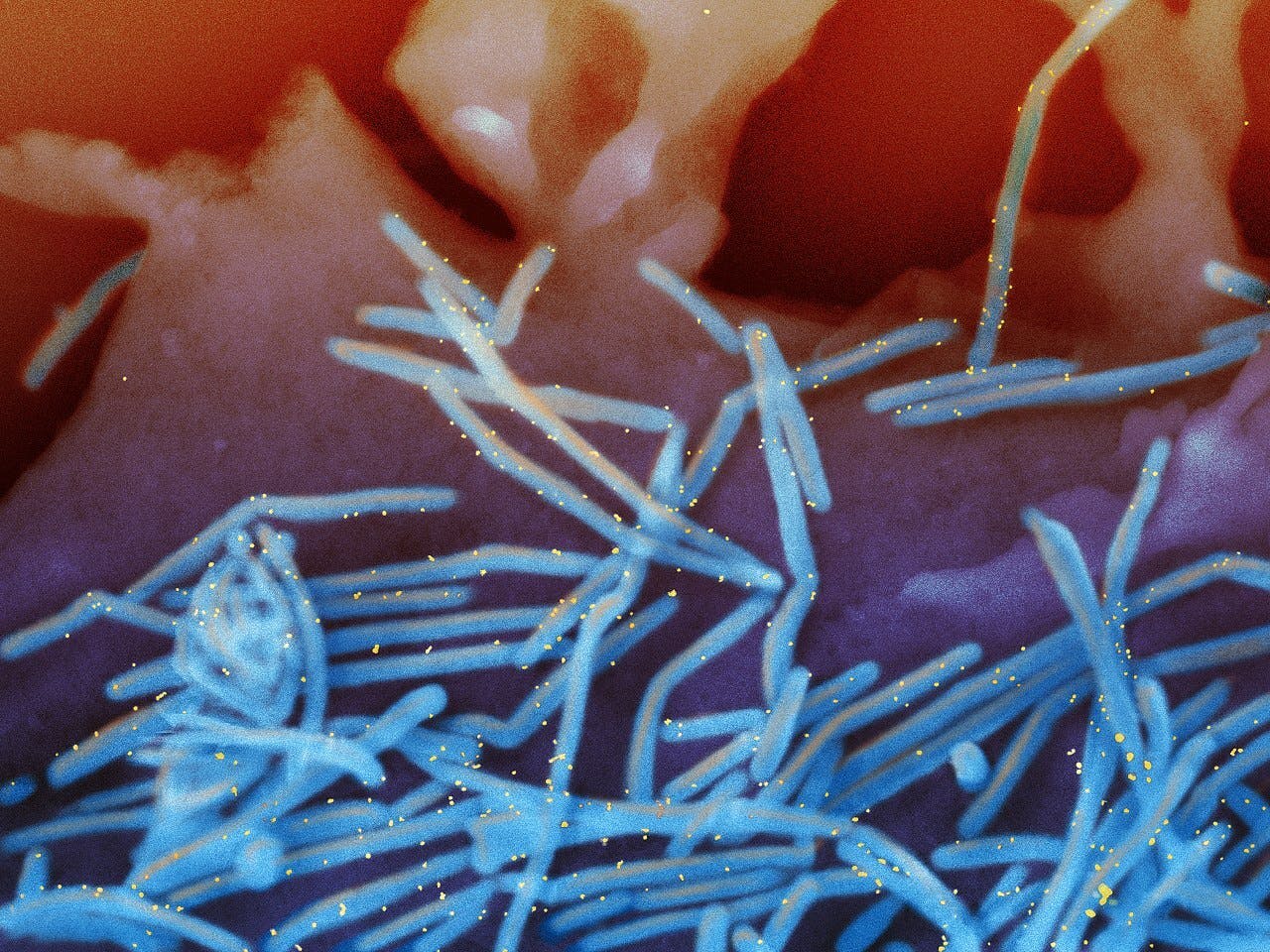
Humaan respiratory syncytial virus (RSV) in longcellen. De virusdeeltjes zijn blauw gekleurd, de gele stipjes zijn goudnanodeeltjes met daarop antilichamen die aan RSV binden.
NIAID via Wikimedia Commons CC BY 2.0Dus de techniek is niet meer je hoofdinteresse?
“Ik heb altijd veel interesse gehad in de biologische vragen en deze technieken helpen je daarbij. Ik wil me blijven richten op het toepassen van geavanceerde analysetechnieken om beter te begrijpen hoe virussen werken, maar ook hoe ons immuunsysteem reageert op virussen. En die kennis wil ik graag gebruiken om nieuwe geneesmiddelen en vaccins te ontwerpen. Ik vind de techniek fascinerend, maar het is een middel, geen doel op zich.”
Na je terugkeer uit Seattle ben je ondernemer geworden met de oprichting van Snijder Bioscience, een adviesbedrijfje. Waarom die stap?
“Ik zie het deels als een tussenstap die me in staat stelt om me goed te oriënteren op wat ik precies wil gaan doen. Na twee jaar werken als postdoc in Seattle begon ik me af te vragen of ik in de academische wereld moest blijven of dat het bedrijfsleven een betere optie zou zijn. Of misschien een instantie als de Europese Centers for Disease Control. Daar ben ik nog niet uit en ik wil daar goed over nadenken. Ik sta absoluut open voor een academische positie, maar als er een andere mogelijkheid is om aan virussen en nieuwe vaccins te werken, dan sluit ik dat niet uit. Ook in de ‘echte wereld’ is dit een belangrijk onderwerp waar nog veel aan te doen is.”

