Materialen die de natuurlijke omgeving van levende cellen nabootsen zijn interessant voor medische toepassingen. Bijvoorbeeld om uit stamcellen lichaamseigen weefsels te kweken om schade in het lichaam te herstellen. Om dat goed te doen is het belangrijk dat de stijfheid van het materiaal kan variëren, want daar reageren cellen op. Chemici uit Nijmegen hebben nu een materiaal gemaakt dat heel gecontroleerd stijver en weer soepeler wordt.
De weefsels en organen in ons lichaam bestaan uit cellen die allemaal omgeven zijn door een laagje flexibel, maar tegelijkertijd stevig materiaal, de zogeheten extracellulaire matrix of simpelweg ‘matrix’. De stijfheid van de matrix verandert voortdurend en dat heeft grote invloed op het gedrag van de cellen. De beweging van spieren, de aanmaak van botweefsel, het ontstaan van littekenweefsel, de groei van stamcellen en ook de vorming van tumorweefsel hebben allemaal te maken met veranderingen in de stijfheid van de matrix.
Vanwege de grote invloed van de matrix op het gedrag van cellen proberen wetenschappers met biologische of synthetische (in het laboratorium gemaakte) bouwstenen materialen te maken die de natuurlijke matrix nabootsen. Onder andere om het gedrag van cellen in een meer levensechte omgeving te kunnen bestuderen, maar ook om stamcellen in het lab uit te laten groeien tot weefsels die schade in het lichaam kunnen herstellen.
Gelatinepudding
Zo’n nagemaakte matrix valt best te vergelijken met een gelatinepudding – een soepel, maar ook stevig materiaal dat heel veel water bevat. In vaktermen heet dit een hydrogel en die bestaat uit lange strengen (polymeren) die onderling een sterk netwerk vormen. Dit netwerk kan heel veel water opnemen, waardoor het geheel opzwelt en je een stevige ‘pudding’ krijgt. Inmiddels zijn er al heel veel hydrogels gemaakt waarvan de stijfheid toeneemt in reactie op een bepaald signaal, net als bij het biologische voorbeeld. Maar eenmaal verstijfd, is het effect blijvend. Je kunt niet, zoals de echte matrix, weer terug naar de oorspronkelijke toestand. Bovendien is er heel veel signaal nodig voor een heel klein effect.

De synthetische hydrogels lijken qua stevigheid op deze vrolijke toetjes.
Ji-Elle via Wikimedia Commons CC BY SA 3.0De onderzoeksgroep van chemicus Paul Kouwer, assistant professor aan de Radboud Universiteit Nijmegen is er nu in geslaagd een hydrogel te maken die in reactie op een kleine verandering een enorme sprong in stijfheid maakt, maar ook even zo makkelijk weer terugkeert naar de uitgangssituatie. Ze gebruiken hiervoor twee verschillende netwerken die zich tijdens de vorming door elkaar heen vlechten. Het ene netwerk, genaamd PIC, is een zogeheten semi-flexibel netwerk en is gevoelig voor mechanische belasting. Zodra er een kracht op wordt uitgeoefend, bijvoorbeeld door eraan te trekken, raken de ketens in het netwerk overstrekt en worden stijf. Alsof je een elastiekje maximaal uitrekt. PIC is een heel gevoelig materiaal, een kleine kracht is al voldoende om een veel stijvere gel te krijgen.
De kracht is afkomstig van het tweede netwerk, genaamd PNIPAM. Dit is een flexibel materiaal dat heel goed opzwelt in water, maar het is ook temperatuurgevoelig. Zodra de temperatuur een bepaalde waarde overstijgt, rollen de PNIPAM ketens zich juist weer op en trekt het netwerk zich samen. Die eigenschap gebruiken Kouwer en collega’s om het PIC netwerkt een zetje richting verstijving te geven. Omdat beide netwerken kriskras door elkaar heen zitten, is een kleine temperatuurverhoging voldoende om PNIPAM te laten samentrekken, waardoor er aan het PIC netwerk wordt getrokken. Als reactie daarop verstijft PIC en wordt de gehele gel veel stijver. Dat gaat heel snel. “Een temperatuurverschil van slechts één graad is voldoende om onze hydrogel meer dan tien keer zo stijf te laten worden”, zegt Kouwer. “Het proces is volledig omkeerbaar. Zodra de temperatuur weer een graad daalt, zwelt PNIPAM weer op en krijgt de gel weer de oorspronkelijke soepelheid terug. We kunnen dit wel honderd keer herhalen met steeds hetzelfde resultaat.”
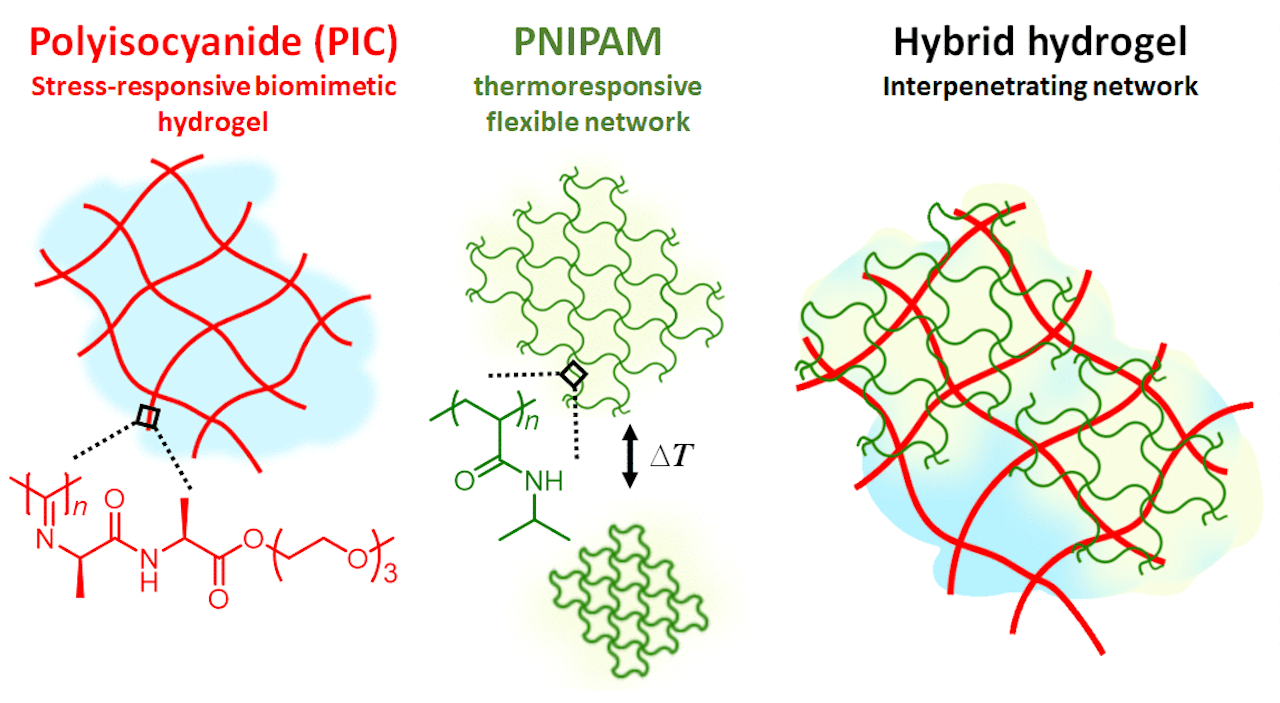
Schematische weergave van de hydrogel van Kouwer en collega’s. Zodra het PNIPAM netwerk (groen) onder invloed van een kleine temperatuurstijging samentrekt, zorgt dit voor een kracht op het PIC netwerk (rood) dat hierdoor verstijft.
P. de Almeida, et al., Nat Comm (2019), doi:10.1038/s41467-019-08569-4
Cellen gekweekt in een PIC gel
Kaizheng LiuCellen kweken
Volgens Kouwer levert zijn nieuwe hydrogel een veel betere nabootsing van de natuurlijke omgeving van levende cellen. Maar wat gaat hij daarmee doen? “We zijn nu bezig om cellen te kweken in deze hydrogel en dan willen we bestuderen hoe de cellen reageren op verstijving en ontspanning van hun omgeving. We kunnen dan direct meten hoe bijvoorbeeld de eiwitexpressie in de cel verandert. Welke eiwitten worden meer of juist minder geproduceerd? We weten dat cellen op die manier omgaan met veranderingen, maar hoe dat in de tijd gaat en wat precies het antwoord van de cel is op welke verandering, dat weet eigenlijk nog niemand. We hopen met onze gel deze processen op een realistische manier na te bootsen.”
Kouwers inspiratie voor het combineren van twee netwerken tot een hydrogel die kan reageren op signalen van buitenaf is het werk van Jian Ping Gong, hoogleraar aan de Hokkaido Universiteit in Japan. Gong’s gebruik van twee netwerken enkele jaren geleden is door veel groepen in het hydrogel-veld opgepakt. “Zij is echt heel goed”, reageert Kouwer. “Gong is de pionier in dit veld.” Haar groep publiceerde onlangs in het tijdschrift Science een nieuw materiaal, ook een combinatie van twee netwerken, dat je kunt ‘trainen’ om sterker te worden. Net zoals dat gaat in onze spieren en botten. Mechanische belasting zorgt voor een stijvere omgeving van de botcellen en in reactie daarop gaan botcellen meer mineralen produceren, waardoor onze botten harder worden.
Zwakke plekken versterken
Het materiaal van Gong laat vergelijkbaar gedrag zien. Door het verder uitrekken van de gel, wordt het geheel steeds stijver. Kouwer: “Het is een heel slimme truc die ze laat zien. De mechanische belasting zorgt ervoor dat het ene netwerk zo verstijfd dat het andere wordt stukgetrokken. Dat zorgt voor reactieve uiteindjes in het netwerk die graag weer verder reageren tot nieuwe ketens. Het netwerk breekt natuurlijk op de zwakste plekken. Die worden dan gerepareerd en zo ontstaat stapsgewijs, met iedere nieuwe schade, een steeds sterker materiaal.”
In haar artikel wijst Gong op de mogelijkheid om de zichzelf versterkende gel te gebruiken in bijvoorbeeld soft robotics, robots van zachte materialen, of ‘slimme’ materialen die kunnen reageren op hun omgeving. Voor het kweken van cellen is deze hydrogel minder geschikt, zegt Kouwer. “Daarvoor zit er veel te weinig water in. Maar ze bieden wel een mooie nabootsing van collageen, het eiwit dat zorgt voor de stevigheid van heel veel weefsels in ons lichaam. Collageen bestaat ook uit dynamische netwerken en we weten dat deze reageren op belasting. Op de plaatsen waar het collageen netwerk het meest wordt belast, ontstaat meer collageen.”

