Veel mensen overleven een hartinfarct, maar de schade aan hun hart is blijvend. Amerikaanse onderzoekers hebben een gel ontwikkeld die in het hart geneesmiddelen afgeeft. In muizen zorgt dit voor de aanmaak van nieuwe, gezonde spiercellen.
Jaarlijks worden in Nederland dertigduizend mensen getroffen door een hartinfarct, beter bekend als een hartaanval. Dat betekent dat iedere dag opnieuw ongeveer tachtig mensen, vaak zonder duidelijke signalen vooraf, zich opeens in een levensbedreigende situatie bevinden.
Bij snel handelen overleeft het overgrote deel van de patiënten een hartinfarct, maar de opgetreden schade aan deze holle spier is blijvend. In het tijdschrift Nature Biomedical Engineering laten Amerikaanse onderzoekers zien hoe ze slapende hartspierstamcellen in muizen activeren en laten groeien. Dat moet het hart helpen om zichzelf te herstellen.
Slapende spiercellen
Lange tijd werd aangenomen dat het hart niet in staat is om te regenereren – nieuwe cellen aan te maken om zo weer gezond nieuw weefsel te vormen. Maar inmiddels is bekend dat ook in het hart ‘slapende’ voorlopercellen (stamcellen) aanwezig zijn die kunnen uitgroeien tot volwaardige hartspiercellen. Als ze maar de juiste signalen krijgen.
Het vrijmaken en vrijhouden van de verstopte aderen, bijvoorbeeld door een dotterbehandeling of het plaatsen van een stent, heeft de hoogste prioriteit bij het behandelen van een hartinfarct.
HartstichtingOnderzoekers van de Universiteit van Pennsylvania in Philadelphia (Verenigde Staten) onder leiding van Jason Burdick gebruiken microRNA (miRNA) om de voorlopercellen te activeren. Deze kleine stukjes genetisch materiaal binden specifiek aan bepaalde genen, waardoor deze niet meer afgelezen kunnen worden. Door een miRNA te kiezen (er zijn talloze bekend) die bindt aan de genen die zorgen voor de slaapstand in de voorlopercellen, schud je ze wakker. De ‘rem’ gaat eraf, de cel gaat groeien en delen.
Maar hoe krijg je die miRNA’s precies op het juiste moment op de juiste plek in het hart? Bij een hartinfarct is de eerste zorg van artsen om de verstopping(en) in de slagaders op te heffen. Idealiter wil je dan tijdens die ingreep ook meteen de therapie voor herstel toedienen. Lokaal, precies daar waar de hartspier aan het sterven is. En die therapie moet ook een tijdje aanwezig blijven zodat voldoende cellen in actie komen. De oplossing: een stevige, maar flexibele hydrogel die zich nestelt in het getroffen weefsel. Een hydrogel is een netwerk van lange moleculen (polymeren, ofwel kunststoffen) dat veel water opneemt.
Plakken en loslaten
Burdick en zijn team hebben een hydrogel ontwikkeld op basis van twee polymeren die via supramoleculaire interacties een netwerk vormen. Supramoleculaire interacties zijn chemische bindingen die niet ‘vast’ zitten – de moleculen plakken aan elkaar, maar laten ook eenvoudig weer los. Dat levert flexibele, dynamische materialen.
De miRNA’s zitten gebonden aan cholesterol, want dat wordt makkelijk opgenomen door een cel. Zo liften de miRNA’s mee met cholesterol. Het cholesterol bindt aan een van de twee polymeren in de hydrogel. Die binding laat langzaam los, waardoor de miRNA’s geleidelijk vrijkomen uit de hydrogel.
De combinatie van polymeren en miRNA-cholesterol hebben Burdick en collega’s geïnjecteerd in het hart van muizen met een hartinfarct. En dat werkt. Ze laten zien dat een eenmalige injectie leidt tot activering van de voorlopercellen en de groei van nieuwe, gezonde hartspiercellen. Dit effect houdt zeker twee weken aan en bovendien zorgt het voor een meetbare functieverbetering van het muizenhart.
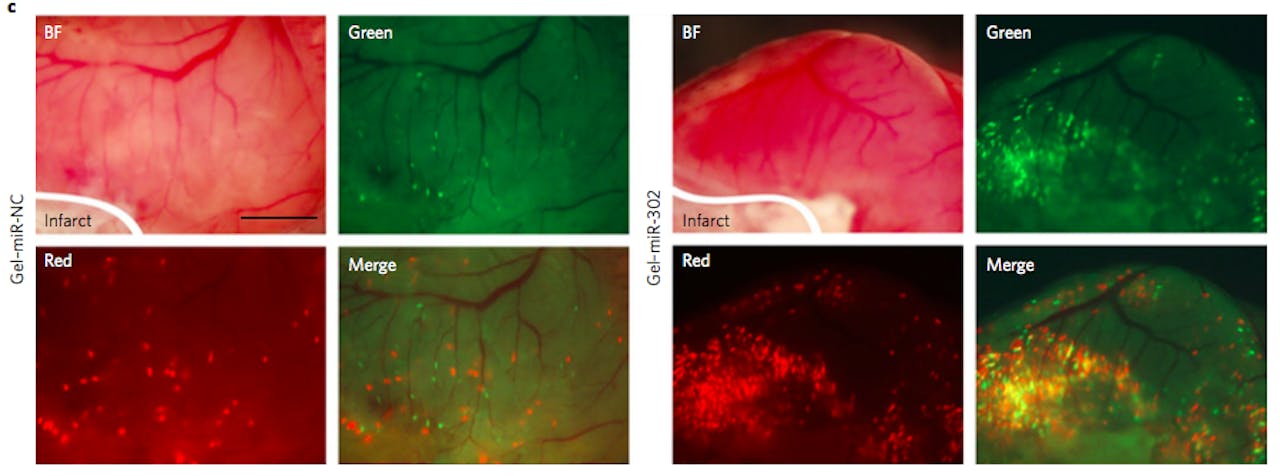
Hartweefsel na injectie van de hydrogel met miRNA in het geïnfarcteerde hart van een muis. Het verschil tussen de foto’s links en rechts is de binding van miRNA aan cholesterol (links niet, rechts wel). De lichtgevende puntjes zijn nieuwe hartspiercellen. Rechts zijn er beduidend meer te zien; binding aan cholesterol helpt dus aantoonbaar om miRNA in de voorlopercellen te krijgen, waardoor deze actief worden en zich gaan delen.
Wang, Liu, et al., Nat Biomed Eng (2017), doi:10.1038/s41551-017-0157-yNiet uniek
Een veelbelovend resultaat, maar toch schuurt er iets. Want in hoeverre zijn deze mooie uitkomsten nou echt het gevolg van deze specifieke hydrogel en deze specifieke miRNA’s? Wie het biomaterialenonderzoek een beetje volgt ziet veel bekends in deze publicatie. “Het klinkt misschien flauw, maar wij doen eigenlijk precies hetzelfde”, reageert Patricia Dankers, hoogleraar biomedische materialen aan de Technische Universiteit Eindhoven. Haar groep onderzoekt materialen voor regeneratieve geneeskunde, onder meer voor toepassing in het hart en de nieren.
Dankers kent het onderzoek van Burdick en zijn groep. “Het is prachtig werk hoor, maar net als zij, gebruiken wij ook een supramoleculaire hydrogel en miRNA gebonden aan cholesterol om hartspierstamcellen te activeren. Het concept is gelijk, maar onze gel bestaat uit een ander polymeer en we gebruiken ook andere miRNA’s. In het biomaterialen onderzoek heeft iedereen een eigen voorkeursmateriaal. Eerlijk gezegd denk ik dat er meerdere mogelijkheden zijn om dit concept van lokale medicijnafgifte via een hydrogel te realiseren.”
Waar zitten de verschillen tussen Dankers’ aanpak en die van Burdick? “Onze hydrogel bestaat uit slechts een polymeer en dat is volgens mij altijd te verkiezen boven een systeem met twee componenten. Bovendien is onze gel heel vloeibaar en we hebben al aangetoond dat je die via een lange katheter in het hart kunt afleveren en dat de gel vervolgens snel geleert [opstijft, red.] In de conclusies van Burdick lees ik dat dit met hun gel nog niet kan.”

Een hartinfarct kondigt zich meestal aan door hevige, drukkende pijn op de borst
HartstichtingHobbels
Grote vraag is natuurlijk of de gel van Dankers ook dezelfde effecten in het hart laat zien. “Wij zijn nog bezig met het aanpassen van een ingediende publicatie. Zo gaat het nou eenmaal, soms is een andere groep net even sneller. Maar we moeten dit resultaat van Burdick nu natuurlijk wel meenemen.” Opvallend genoeg verwijzen Burdick en de overige auteurs voornamelijk naar hun eigen eerdere werk en niet naar dat van andere groepen in het veld. Dankers blijft diplomatiek. “Ik oordeel daar niet over, je weet niet of dat een bewuste keuze is of dat ze het zijn vergeten.”
Het werk van Burdick laat volgens Dankers in ieder geval zien dat het concept zinvol is om verder te ontwikkelen als therapie voor mensen. Maar dan zijn er nog heel wat hobbels te nemen, waarschuwt ze. “Het is altijd lastig om te voorspellen of iets in de mens gaat werken. Hier werken we bovendien met twee onderdelen die compleet nieuw zijn. Je injecteert een synthetische gel direct in het hart, zoiets bestaat nog niet. En miRNA’s als geneesmiddel zijn ook nieuw. Dat maakt het goedkeuringstraject er niet eenvoudiger op. Maar toch denk ik dat het interessant genoeg is om het te proberen.”

