Samenwerken kan op allerlei manieren. Ook enzymen zijn er heel goed in, zo laat een publicatie in Science zien. Als je zorgt dat ze hun hulpstoffen recyclen, krijg je een proces dat veel efficiënter en schoner is dan de huidige industriële productiewijze.

De chemische industrie produceert en verwerkt jaarlijks grote hoeveelheden amines. Deze verbindingen met een -NH2 groep (een stikstofatoom met daaraan twee waterstofatomen) vormen het startmateriaal voor veel verschillende kunststofvezels, maar ook voor bijvoorbeeld geneesmiddelen en kleurstoffen.
De huidige chemische productieprocessen zijn energievretend en leveren veel afval. Dat moet beter kunnen, zo meende een groep onderzoekers, waaronder Dr. Francesco Mutti en Dr. Tanja Knaus van de Universiteit van Amsterdam. In Science publiceerden ze onlangs een alternatief, waarin ze twee enzymen laten samenwerken om amines te maken met alleen water als bijproduct.
Niet efficiënt
De industrie gebruikt verschillende manieren om amines te maken. In veel gevallen zijn metaalbevattende katalysatoren nodig. Katalysatoren zijn stoffen die een bepaalde chemische reactie mogelijk maken. Een veelgebruikte grondstof is een alcohol, een verbinding met een OH groep (een zuurstof met daaraan een waterstof). Je kunt in een keer de -OH groep vervangen door de -NH2 groep. Dit heet direct amineren, maar dat is niet heel efficiënt. Het kan ook in meerdere stappen, waarbij je de alcohol eerst omzet in een keton, een verbinding met een -CO groep (een koolstof met een dubbele binding naar het zuurstofatoom). Het keton reageert vervolgens via verschillende reactiestappen tot het gewenste amine. Maar ook bij deze aanpak is de opbrengst relatief laag. Bovendien vraagt deze route extra reactie en zuiveringsstappen, wat weer meer afval oplevert.
Bacteriën
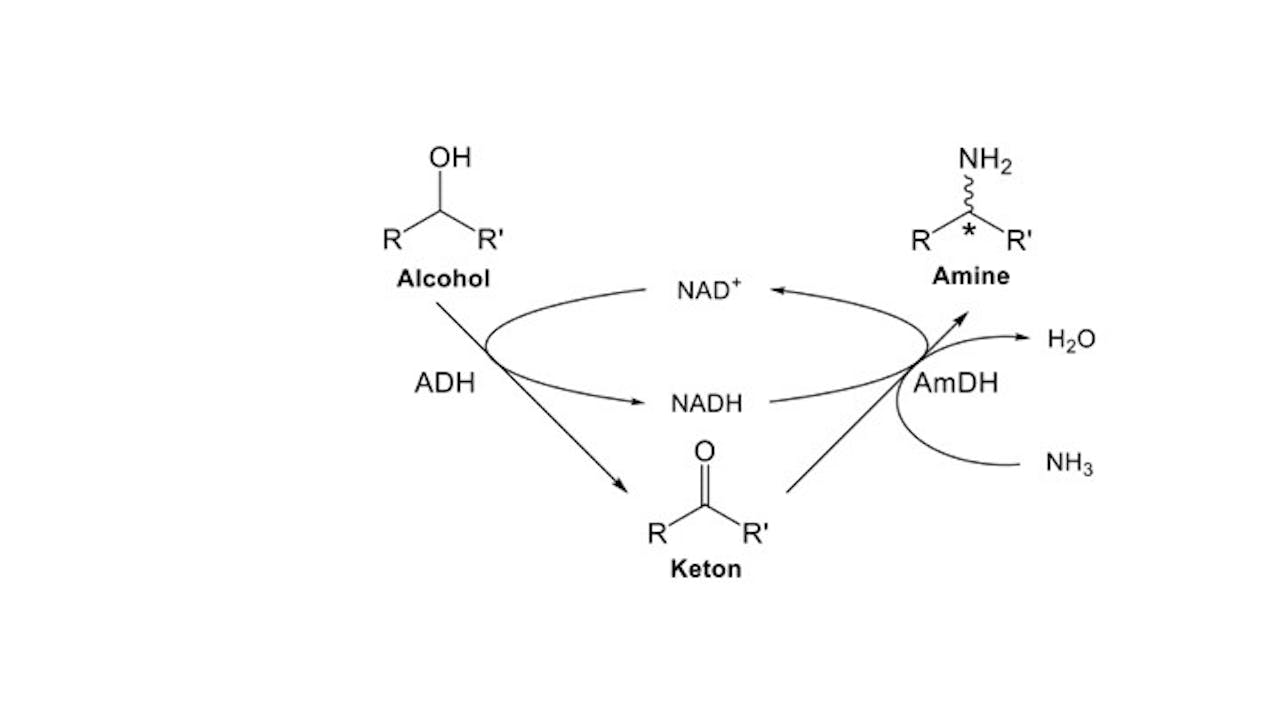
Een alcohol omzetten kan ook anders, zo laten levende organismen zien. Zij maken gebruik van enzymen, de katalysatoren van de natuur. Francesco Mutti, groepsleider van de Biokatalysegroep van het Van ‘t Hoff Institute for Molecular Sciences van de Universiteit van Amsterdam, legt uit. “Alcoholen zijn veelvoorkomende tussenproducten van de stofwisseling in bacteriën. Dankzij het enzym alcoholdehydrogenase kunnen bacteriën een alcohol heel efficiënt omzetten in een keton.” Met een alcoholdehydrogenase kun je dus de eerste step zetten in de synthese van een amine.
Voor de volgende stap, van een keton naar een amine, konden Mutti en collega’s niet een kant-en-klaar enzym uit de natuur plukken. “Amines komen in de natuur nauwelijks voor en een enzym dat een amine omzet in een keton is nog nooit gevonden. Maar we kennen wel aminozuurdehydrogenases. Aminozuren zijn de bouwstenen van eiwitten. Deze enzymen zetten aminozuren, die zoals de naam verklapt ook een aminogroep bevatten, om naar een keton.” Enzymatische reacties zijn omkeerbaar en je kunt ze sturen door de condities aan te passen. Daarmee lijkt deze reactie al heel erg op de tweede stap van het industriële proces.
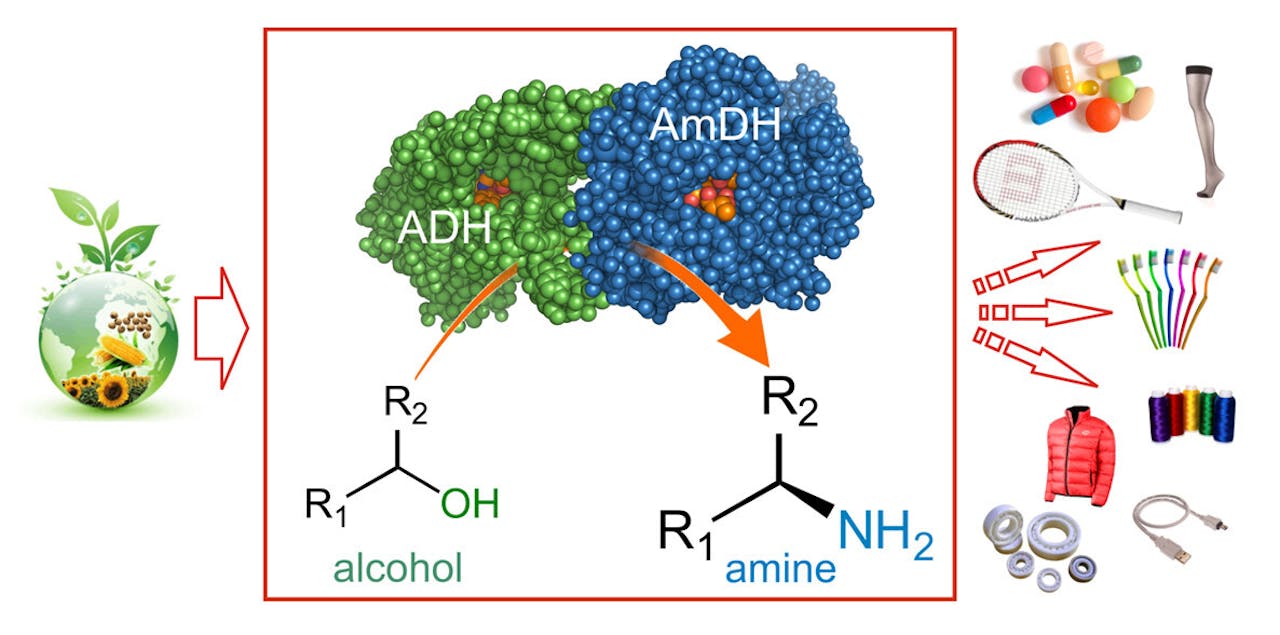
Vanuit een alcohol maken de enzymen alcoholdehydrogenase (ADH) en aminedehydrogenase (AmDH) een amine; de grondstof voor veel verschillende producten, van kunststoffen tot geneesmiddelen.
Tanja Knaus/HIMS/UvA (met toestemming)Gelukkig voor Mutti en zijn groep was een Amerikaanse onderzoeksgroep er al eerder in geslaagd een aminozuurdehydrogenase genetisch zo aan te passen, dat het in staat is om een amine om te zetten in een keton en vice versa. Ze hadden een aminedehydrogenase gemaakt. “De doorbraak in ons werk zit erin dat wij als eerste het potentieel zagen om een aminedehydrogenase te combineren met een alcoholdehydrogenase voor een katalysestap waarbij de enzymen de protonenbron delen”, aldus Mutti. “En dat het is gelukt om die combinatie heel efficiënt in te zetten, waardoor het enige bijproduct water is.”
Aanpassen
Overigens is het niet zo dat de onderzoekers de beide enzymen gewoon van de plank konden pakken. Ook zij hebben nog veel genetic engineering, het genetisch aanpassen van een enzym, moeten verrichten om zowel het alcoholdehydrogenase als het aminedehydrogenase precies de juiste reactiestappen te laten uitvoeren. Mutti verwacht dat dit nodig zal blijven, afhankelijk van het gewenste eindproduct. “We hebben veel verschillende alcoholen gebruikt als startmateriaal en we zien duidelijk dat de activiteit van de katalysatoren verschilt per alcohol. Als dit uiteindelijk in een productieproces wordt toegepast, verwacht ik dat je per gewenst amine nog je enzymen verder moeten aanpassen.”

De weg naar industriële toepassing vraagt nog wel meer werk, benadrukt Mutti. “In onze opzet heb je nog een overmaat aan ammonia nodig om het proces richting het amine-eindproduct te duwen. Een van onze plannen is om nog een derde katalysator toe te voegen die een niet-omkeerbare omzetting aan het amine uitvoert. Dan voorkom je dat je eindproduct weer reageert en dan heb je ook veel minder ammonia nodig.”
Maakt dat het systeem niet heel complex? Drie katalysatoren? Mutti is er optimistisch over. “Het mooie van enzymen is dat ze onderling compatibel zijn. Als je op een klassieke chemische manier van stof A via stof B naar stof C wilt gaan, lukt je dat nooit in een reactorvat. Dat wordt een grote bende. Maar met een enzym kun je heel goed een serie van reactiestappen in dezelfde omgeving uitvoeren. En als je het zo afstemt dat ze dezelfde hulpstoffen delen en recyclen heb je een heel efficiënt en schoon systeem.”

