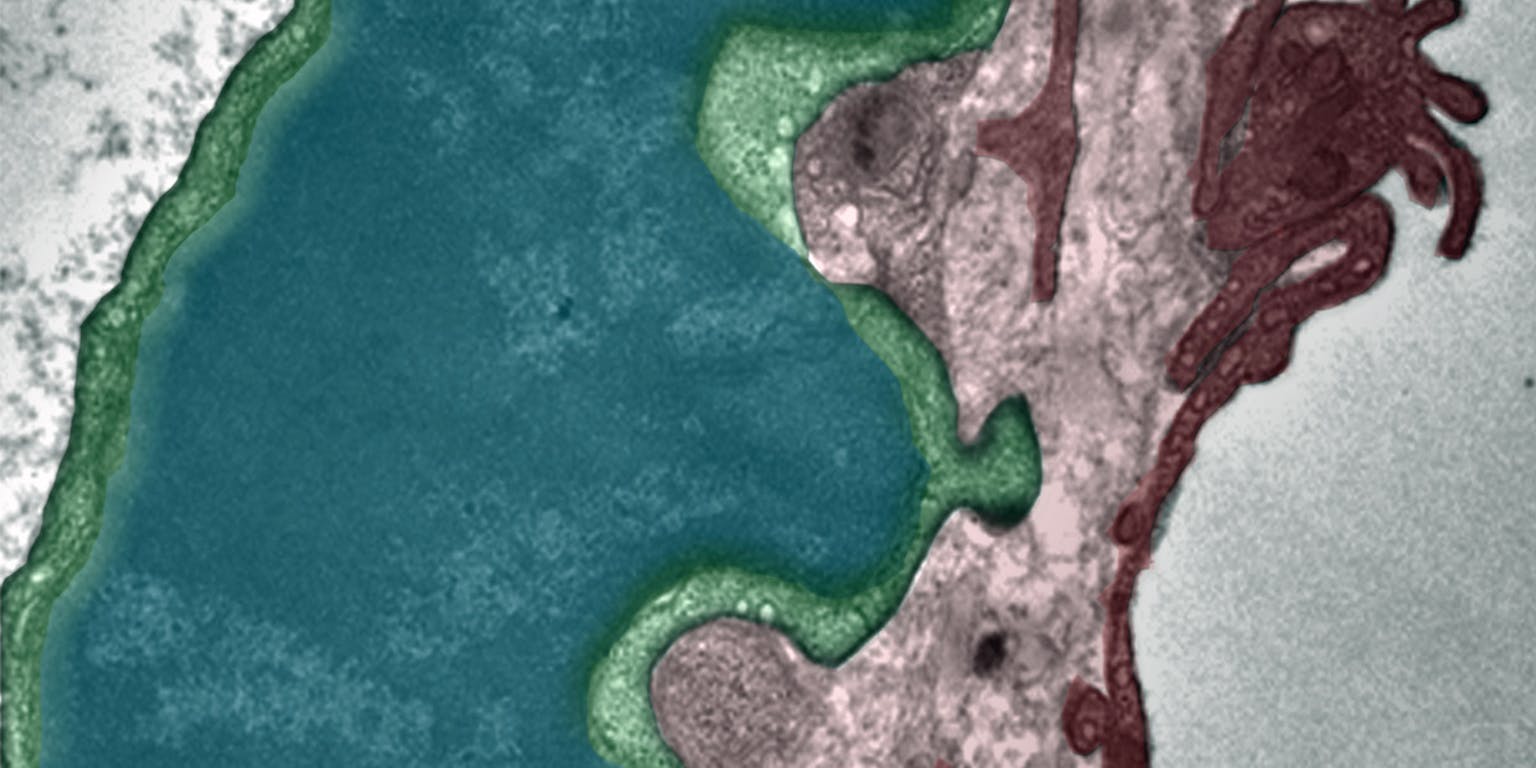
Het listige gedrag van tumoren is angstaanjagend. Tumoren weten namelijk cellen van het immuunsysteem zodanig te manipuleren dat ze de tumor gaan helpen. Chemicus Martijn Verdoes werkt aan manieren om de verdedigingswal van de tumor te doorbreken en de bad guys weer aan de goede kant te krijgen.
Het verdedigingssysteem in ons lichaam, het immuunsysteem, moet ons beschermen tegen schade en ziekte. Of het nou virussen van buitenaf zijn of beschadigde cellen van binnenuit – het immuunsysteem herkent de bedreiging en rekent ermee af. Het immuunsysteem heeft alles in huis om ook kankercellen te herkennen en te vernietigen. Toch kunnen tumoren vaak lange tijd ongestoord hun gang gaan.
Door allerlei ‘niks aan de hand’-signaalstoffen te produceren zorgt een tumor ervoor dat het immuunsysteem geen argwaan krijgt. “Tumoren kunnen zichzelf heel goed onzichtbaar maken en zo het immuunsysteem omzeilen”, zegt chemicus Martijn Verdoes, assistant professor bij de Afdeling Tumor Immunologie van het Radboudumc in Nijmegen en onderzoeker binnen het Nederlandse Institute for Chemical Immunology. En daar blijft het niet bij. Een tumor kan namelijk ook immuuncellen voor zich laten werken. Het is de wereld op z’n kop: immuuncellen die een tumor niet bestrijden, maar juist helpen om nog verder te groeien.
Van vuilnisman tot bouwvakker
Verdoes legt uit hoe een tumor dat voor elkaar krijgt. “Ze lokken met behulp van signaalstoffen onder andere macrofagen naar zich toe. Macrofagen zijn de vuilnismannen van het immuunsysteem die alles wat beschadigd of vreemd is opnemen en verteren. De tumorcel kan de macrofagen dusdanig manipuleren dat ze niet langer als vuilnisman te werk gaan, maar eerder als bouwvakker die aan de slag gaat voor de tumor. De nuttige macrofagen veranderen in bad guys. Ze scheiden groeifactoren uit en breken omliggend weefsel af, zodat de tumor de ruimte krijgt om te groeien, om bloedvaten aan te leggen en om verder het gezonde weefsel binnen te dringen en uitzaaiingen te vormen.”
De tumor heeft enorm veel baat bij het werk van deze Tumour Associated Macrophages (TAMs). “TAMs zijn heel belangrijk voor de tumor. Sommige tumoren bestaan zelfs voor de helft uit deze gemanipuleerde immuuncellen.” Maar wat goed is voor de tumor is automatisch slecht voor de patiënt. Uit klinisch onderzoek is inmiddels duidelijk dat tumoren met veel TAMs veel minder gevoelig zijn voor behandeling. Deze patiënten hebben meestal slechte vooruitzichten. “De tumor creëert voor zichzelf een heel gunstige en goed afgeschermde micro-omgeving. Het is voor het immuunsysteem, maar ook voor medicijnen, moeilijk om daar doorheen te breken.” Maar Verdoes is een zwakke plek in deze barrière op het spoor.
Eiwitten knippen
Die zwakke plek is een familie eiwitten: de cathepsines. Dit zijn proteases, enzymen die andere eiwitten in stukken kunnen knippen. Proteases herkennen heel specifiek een bepaalde volgorde van aminozuren, de bouwstenen van eiwitten. Is het de juiste volgorde, dan verbreken ze de binding tussen die aminozuren. “Er werd altijd gedacht dat de cathepsines vooral tot taak hadden opgenomen eiwitafval in de cel verder op te knippen, maar nu zien we ze ook opduiken in kanker en verschillende ontstekingsziekten, zoals reuma, astma en taaislijmziekte.”
Voordat Verdoes naar Nijmegen kwam, deed hij aan de Universiteit van Stanford in Californië onderzoek naar manieren om de verschillende cathepsines zichtbaar te maken in weefsel. “We wilden onderzoeken in welke soort cellen in de tumor de cathepsines precies zitten en wat hun specifieke rol is.” Hij ontwierp heel gericht verschillende activity-based probes: relatief kleine moleculen die specifiek aan een enzym kunnen binden op basis van hun chemische activiteit. Door aan de probe ook een lichtgevende chemische groep te binden, zorg je voor de zichtbaarheid. “We hebben de probes zo gemaakt dat zodra deze bindt aan een cathepsine, er een deel van de probe afvalt en het fluorescerende signaal zichtbaar wordt. Dus daar waar je licht ziet, zitten cathepsines.”
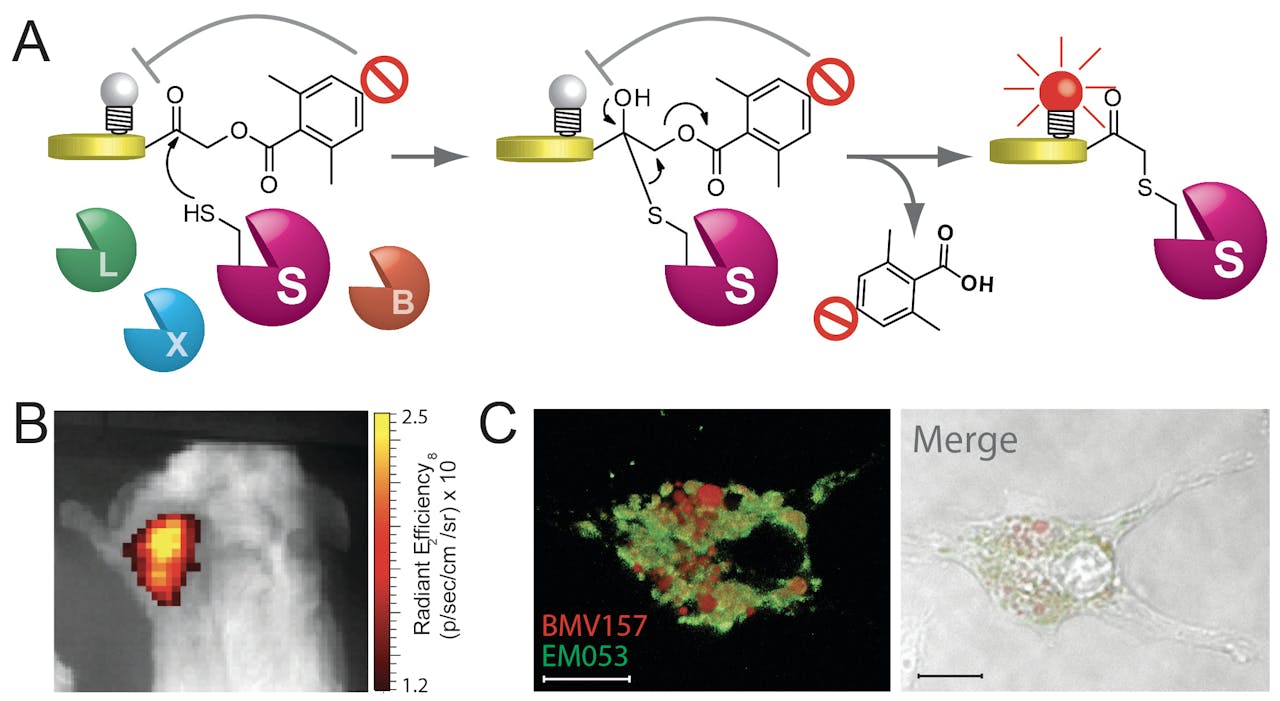
A: Werkingsmechanisme van een quenched Activity-Based Probe (qABP): de chemische groep aan de rechterkant dooft het lichtgevende signaal. Deze groep heet een quencher. Het molecuul is dan ‘donker’ op opnames. Alleen na reactie met het actieve protease (de gekleurde schrijfjes S, B, L of X) vertrekt de quencher. Het protease heeft nu een lichtgevend label en wordt zichtbaar. B: Een muis met borstkanker; de tumor is zichtbaar door de binding van een protease aan het lichtgevende label. C: Gebruik van een qABP laat in levende immuuncellen de specifieke locatie van cathepsine S (rood) zien ten opzichte van de andere cathepsines (groen).
M. Verdoes/RUMC (met toestemming)Er zijn elf verschillende cathepsines die je overal in je lichaam aantreft, maar tumoren produceren opvallend grote hoeveelheden ervan. Met zijn probes lukte het Verdoes om tumoren op te sporen door te zoeken naar de verhoogde protease-activiteit. Ander onderzoek liet zien dat in de tumor de TAMs verreweg de meeste cathepsines produceren. Naast probes die met zo’n beetje alle cathepsines kunnen reageren, publiceerde Verdoes in 2015 samen met zijn voormalige collega’s van Stanford ook een nieuwe probe die heel specifiek aan een type cathepsine bindt, genaamd cathepsine S. Deze cathepsine komt vrijwel uitsluitend voor in immuuncellen.
In de val
Verdoes legt uit hoe het binden van cathepsines kan helpen om de tumor aan te pakken. “Eigenlijk lokken we de cathepsines in de val. Een deel van onze probe lijkt precies op het stukje eiwit dat de cathepsine normaal gesproken doorknipt. Maar we hebben daar een soort klem aan gekoppeld. Zodra een cathepsine bindt aan dat specifieke stukje, blijft het vastzitten. De cathepsine is daarmee uitgeschakeld.” Op die manier blokkeer je een belangrijke functie in de TAMs, want die kunnen nu veel minder goed functioneren voor de tumor.
Een goed begin, maar Verdoes denkt verder. “We weten dat je TAMs weer terug kunt transformeren naar de ‘goede’ macrofagen. Mijn plan is nu om een molecuul te ontwikkelen dat deze transformatie in gang zet. Zo’n molecuul kun je dan aan de probe koppelen. Zodra die bindt aan een cathepsine komt dit transformatiemolecuul vrij en kan dan de macrofaag beïnvloeden. Als we de bad guys weer aan de goede kant kunnen krijgen, kunnen we die barrière rond de tumor afbreken, waardoor de tumor veel kwetsbaarder wordt.”
Het zal nog veel onderzoek vragen om dit te realiseren, maar ook als het allemaal lukt levert dit volgens Verdoes niet hét middel tegen kanker. “Ik geloof absoluut niet in een magic bullit als het gaat om kanker. Je hebt meerdere aanvalslijnen nodig. Daarom werken wij ook aan manieren om het immuunsysteem veel sterker te laten reageren op tumorcellen. Ik geloof sterk in de combinatie van enerzijds zorgen voor een krachtige immuunrespons en anderzijds het wegnemen van de vestingwal die de tumor zelf opwerpt. Als dat beide lukt, maak je echt een kans.”