Eindhovense chemici wisten een negentiende eeuws vermoeden van de vergetelheid te redden door onverwacht met heel modern bewijs op de proppen te komen. Het draait allemaal om deeltjes die elkaars spiegelbeeld zijn. En het begon met een onzalig plan dat veel te ingewikkeld leek.
Het verhaal begint in 1894. Dan verschijnt een boek van de Nederlandse chemicus J.H. van ‘t Hoff, die in 1901 de allereerste Nobelprijs voor Scheikunde zal ontvangen, waarin hij stelt dat ‘als een chiraal molecuul is opgelost in een chiraal oplosmiddel, het oplosmiddel een verschillend effect zal hebben op beide enantiomeren, vooral op de oplosbaarheid’.
Aha, maar wat zegt Van ‘t Hoff hier nou eigenlijk? Het draait allemaal om chiraliteit ofwel spiegelbeeldsymmetrie – het verschijnsel dat sommige moleculen in twee versies bestaan die elkaars spiegelbeeld zijn. Ze zijn volledig identiek, behalve hun ruimtelijke vorm. Net zoals je linker- en rechterhand. Beide handen hebben een duim, vier verschillende vingers, een handpalm en een handrug, maar toch is hun ruimtelijke vorm niet hetzelfde. Ze zijn elkaars spiegelbeeld.
Links of rechts?
Beide spiegelbeeldmoleculen hebben veel dezelfde eigenschappen, maar verschillen toch net in de manier waarop ze aan andere moleculen binden. Als chemici zo’n molecuul maken in het lab, dan krijgen ze normaal gesproken van beide evenveel. Maar in de natuur heerst een duidelijke voorkeur voor een van de twee varianten. Zo zijn alle aminozuren, waar de eiwitten uit bestaan, ‘linksdraaiend’. Alle suikers, die onder meer aan het DNA hangen, zijn rechtsdraaiend. En de dubbele DNA helix is zelf ook rechtsdraaiend.
Waarom en hoe er in de natuur zo’n uitgesproken voorkeur is ontstaan, is nog een open vraag. Maar doordat die voorkeur er is, moet je hier serieus rekening mee houden als je probeert een chiraal molecuul, bijvoorbeeld een geneesmiddel, te laten binden aan een eiwit. Want de kans is groot dat de ene vorm wel goed bindt en de andere niet. Net zoals een linkerhand goed in een linkerhandschoen past, maar voor de rechterhand gaat dat niet op.
Een berucht voorbeeld van hoe dat mis kan gaan is het drama rond het geneesmiddel Softenon dat eind jaren vijftig op de markt kwam. Ontwikkeld als een slaapmiddel en nota bene als middel tegen ochtendmisselijkheid, bleek het in zwangere vrouwen ernstige aangeboren afwijkingen aan de foetus te veroorzaken. Het actieve ingrediënt is het chirale molecuul thalomide, waarbij de ene spiegelbeeldvorm de gewenste werking levert, terwijl de andere vorm desastreuze gevolgen heeft. Doordat thalomide in het lichaam continu van vorm verandert – de spiegelbeelden gaan in elkaar over – is nooit achterhaald welke van de twee vormen de boosdoener is. Maar dat spiegelbeeldsymmetrie iets is om serieus rekening mee te houden is sindsdien op afschuwelijke wijze duidelijk geworden.
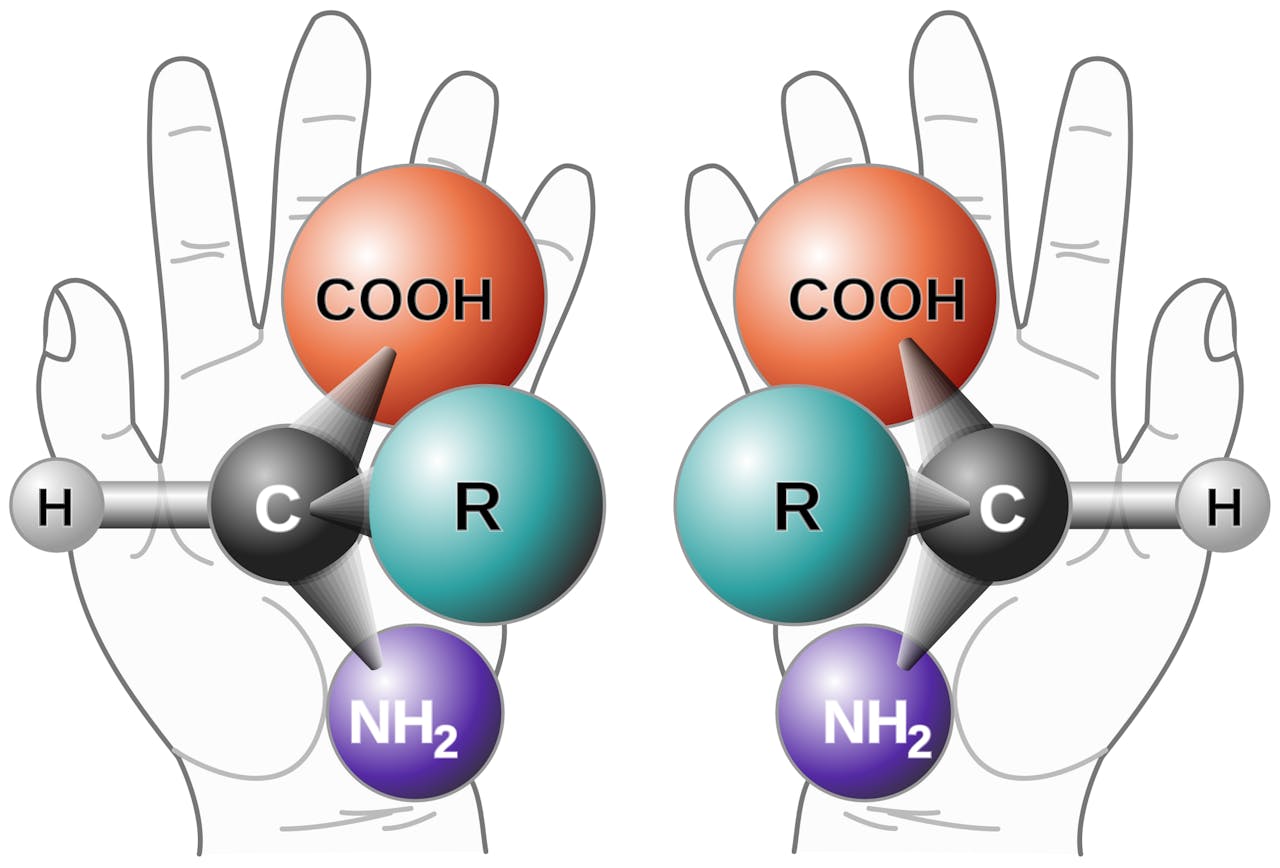
Een molecuul is chiraal als aan het centrale koolstofatoom C vier verschillende groepen zijn gebonden. Deze groepen staan niet in hetzelfde platte vlak, maar steken in verschillende richtingen. R is hier naar voren gericht, terwijl COOH en NH2 naar achteren wijzen. Daardoor kun je, net als bij je beide handen, de twee nooit in exact dezelfde driedimensionale structuur krijgen. Hier is de basisstructuur van een aminozuur afgebeeld, de bouwstenen van eiwitten.
Wikimedia Commons, publiek domeinNiet te meten
De stelling van Van ‘t Hoff is daarom intrigerend en belangrijk. Want als hij gelijk heeft, dan moet je dus rekening houden met de invloed van je oplosmiddel op de reacties die plaatsvinden en op het uiteindelijke product dat je wilt vormen. Helaas leverde Van ‘t Hoff geen experimenteel bewijs voor zijn stelling. Ook in de vele jaren daarna bleef de stelling onbewezen rondsluimeren. Maar nu, ruim 120 jaar later, is de groep van Bert Meijer, hoogleraar organische chemie aan de TU Eindhoven, vanuit een totaal onverwachte hoek op bewijs voor de stelling gestuit.
Wat blijkt: het effect waar Van ‘t Hoff op zinspeelt bestaat wel degelijk, maar het is veel te klein om direct te meten. Doordat het team in Eindhoven werkt aan heel lange moleculen, zogeheten supramoleculaire polymeren, krijg je een optelsom van al die kleine effecten tot iets dat je wel kunt meten. Echter, ten tijde van Van ‘t Hoff en van generaties chemici na hem, waren dit type moleculen nog helemaal niet bekend. Van supramoleculaire chemie had toen nog nooit iemand gehoord. “We begrijpen nu waarom het zo lang duurde voordat iemand de voorspelling van Van ‘t Hoff via experimenten kon toetsen”, aldus Meijer.
Waarom besloot Meijer eigenlijk om zich in deze negentiende-eeuwse stelling te verdiepen? “Dat was helemaal niet het uitgangspunt, maar hier liepen we gaandeweg tegenaan.” Meijer leunt achterover en gaat er eens goed voor zitten. “Het begon allemaal met een idee van Marcin Ślęczkowski, toen nog promovendus in mijn groep. Een idee dat ik eerst helemaal niet zag zitten.”
Stapelende schijfjes
De groep van Meijer ontwerpt en maakt supramoleculaire polymeren die zichzelf vormen vanuit de losse bouwstenen. Die bouwstenen zijn platte schijfjes die spontaan op elkaar gaan stapelen, waardoor lange strengen ontstaan. Door de specifieke vorm van de schijfjes krijgt zo’n streng een draaiing, zoals een kurkentrekker ofwel een helix. Die kan twee richtingen hebben: linksom of rechtsom. Meijer: “Wij onderzoeken wat de invloed is van chirale monomeren, dus schijfjes waarvan twee spiegelbeeldvormen bestaan, op de draairichting van de helix. We zoeken naar chirale controle. Hoeveel ‘overmacht’ van één van de twee spiegelbeelden heb je nodig om te zorgen dat je eindproduct de draairichting krijgt die jij wilt? Zodat je precies weet wat je moet doen om bijvoorbeeld alleen maar linksdraaiende strengen te krijgen.”
In dit soort onderzoek spelen sergeant-en-soldaat experimenten een belangrijke rol. De soldaten zijn zogeheten achirale monomeren. Dit zijn bouwstenen zonder spiegelbeeld en dus zonder richtingsvoorkeur. De sergeanten zijn de chirale bouwstenen, met een richtingsvoorkeur. Waar Meijer en zijn groep naar zoeken is de minimale hoeveelheid sergeanten die je nodig hebt om de draairichting van de soldaten te bepalen. “We bestuderen daarnaast ook nog de rol van het oplosmiddel, bijvoorbeeld wat er gebeurt als je achirale bouwstenen en een chiraal oplosmiddel combineert. Daar zien we dat ook het oplosmiddel een voorkeur heeft voor een van de twee draairichtingen van het eindproduct.”
Onzalig plan
Zo uitgelegd klinkt het allemaal best eenvoudig, maar schijn bedriegt. Meijer: “Dit zijn ingewikkelde experimenten om uit te voeren, te analyseren en goed te beschrijven. En toen kwam Marcin met het onzalige plan om chirale monomeren in een chiraal oplosmiddel te bestuderen. Mijn eerste reactie was: ‘Waarom zou je dat in hemelsnaam doen? Het is nu al moeilijk genoeg, waarom wil je het nog ingewikkelder maken?’ Maar hij ging er toch mee aan de slag.”
Marcin Ślęczkowski, inmiddels postdoctoraal onderzoeker bij het Aachen Maastricht Instituut voor Biobased Materialen (AMBIM), staat die discussie nog levendig voor de geest. “Bert zag het totaal niet zitten, maar ik had sterk het gevoel dat we dit moesten doen.” Eerst viel het experimentele werk flink tegen, maar na wat aanpassingen rolden er opeens intrigerende resultaten uit. Ślęczkowski: “Ik liet het zien aan Bert en het bleef een paar minuten stil. Toen wist ik dat ik iets interessants had gevonden.”
De resultaten van Ślęczkowski’s experimenten lieten duidelijk zien dat de twee spiegelbeelden verschillend reageren op het chirale oplosmiddel. Dankzij de gedetailleerde simulaties van zijn collega Mathijs Mabesoone werd duidelijk wat er precies gebeurt. En dat die verschillen pas tastbaar worden als er een grotere structuur ontstaat. Meijer: “We kwamen erachter dat de twee spiegelbeeldvormen van het monomeer echt verschillen in hun interacties met het oplosmiddel. Het verschil is echter te klein om op het niveau van enkele monomeren te meten. Maar als de twee spiegelbeelden ieder hun ‘eigen’ lange streng gaan vormen, tellen die kleine verschillen bij elkaar op en dan wordt het groot genoeg om wel te kunnen meten.”
Kers op de taart
Dat was al een doorbraak, maar het werd nog mooier toen Ślęczkowski in de literatuur ging zoeken naar vergelijkbare experimenten en resultaten. Die waren nauwelijks te vinden. Wat hij wel vond, was de voorspelling van Van ‘t Hoff over de verschillen tussen enantiomeren in een chiraal oplosmiddel. Precies wat hij en zijn collega’s met de supramoleculaire polymeren hadden aangetoond. Het was de kers op de taart, aldus Ślęczkowski. “We begrijpen nu dat Van ‘t Hoff gelijk had en ook waarom het nog niemand was gelukt om dit om te zetten in experimenten. Je hebt die grotere structuur nodig, anders zie je het niet.”
Hoe mooi deze samenloop van omstandigheden ook is, er was blijkbaar tot nu toe ook niet veel reden om de stelling van Van ‘t Hoff eens grondig te onderzoeken. Ruim 120 jaar konden we zonder. Volgens Meijer levert het voor de supramoleculaire chemie – waarbij moleculen tijdelijk aan elkaar plakken, maar ook weer loskomen – toch belangrijke inzichten. “In de klassieke organische chemie, waarbij je nieuwe, losse moleculen maakt, weten we veel over de rol van het oplosmiddel. Dat geldt ook voor polymeren, de ‘gewone’ kunststoffen. Ook daarvoor begrijpen we goed welke invloed het oplosmiddel heeft. Maar voor de supramoleculaire materialen is dat nog grotendeels onbekend. Ons onderzoek laat zien dat die invloed er wel degelijk is en dat kleine effecten tot iets groots kunnen optellen.”
Doorlopende lijn
Dat is relevant voor de (grootschalige) productie van materialen, zoals coatings die zijn gebaseerd op supramoleculaire chemie. “Dit laat zien dat zelfs een restantje oplosmiddel dat is achtergebleven toch grote invloed kan hebben op het uiteindelijke materiaal dat wordt gevormd. Dat hebben we eerder al laten zien voor water, maar het geldt dus ook voor andere oplosmiddelen. Het oplosmiddel is niet alleen maar een passieve omgeving, het speelt een actieve rol in de reacties die je uitvoert.”
Daarnaast zet het Meijer aan het denken over het ontstaan van de duidelijke chirale voorkeur in de natuur. “Alle aminozuren hebben dezelfde voorkeursrichting en ook de DNA helix draait altijd dezelfde kant. Maar puur chemisch gezien had het ook de andere richting kunnen zijn. Hoe is ooit die voorkeur ontstaan? Ons werk laat zien dat kleine verschillen aan het begin, heel snel kunnen uitgroeien tot een heel sterke voorkeur die onomkeerbaar is. Het is een zichzelf versterkend systeem. Dat is interessant om over na te denken. En daarnaast is het ontzettend leuk dat wij via onverwachte, moderne waarnemingen terecht zijn gekomen komen bij vermoedens die al in de negentiende eeuw leefden. Dat er een doorlopende lijn in het denken is, dat vind ik heel mooi.”

