Twintig procent van ons zorgbudget gaat op aan het bestrijden van de symptomen van erfelijke aandoeningen. En één op de zestien Nederlanders heeft naar schatting zo’n aandoening. Het lukt steeds beter om de genetische defecten te repareren die aan die aandoeningen ten grondslag liggen. Het zou miljoenen besparen, maar ironisch genoeg is het grootste obstakel nou juist geld.
Je DNA zit vol met codes die ervoor zorgen dat je lichaam eiwitten aanmaakt. Al die eiwitten zijn ervoor om een chemische reactie in je lichaam mogelijk te maken. Wordt een eiwit niet goed aangemaakt, dan vindt de reactie waarbij dat eiwit betrokken is niet of niet goed plaats, en dan word je mogelijk ziek. Er zijn meer dan 7.500 ziektes die komen door een verkeerd gemaakt eiwit. Omdat ze eigenlijk komen door fouten in het DNA, en je het DNA van je ouders krijgt, noemen we ze erfelijke ziektes.
De meeste van die ziektes zijn extreem zeldzaam: het is vaak letterlijk de kans van één op een miljoen geboortes om het te krijgen, wat er in Nederland op neerkomt dat er zo’n zestien of zeventien patiënten lijden aan zo’n ziekte. Maar sommige erfelijke aandoeningen zijn algemener, zoals taaislijmziekte.
Wel bestrijden, niet genezen
Zeldzaam of niet, de gevolgen van een erfelijke aandoening kunnen voor de patiënt zelf erg groot zijn. Neem nu het severe combined immunodeficiency syndrome (SCID). Een genetisch defect zorgt er dan voor dat je geen antilichamen kunt aanmaken. Zelfs de onschuldigste snotneus wordt dan fataal. De enige remedie was aanvankelijk om kinderen die met SCID werden geboren in een steriele luchtbel groot te brengen, waaraan SCID ook zijn bijnaam dankt: ‘The bubble boy disease’. Of neem bijvoorbeeld de ziekte van Pompe: een ziekte waarbij het eiwit dat glycogeen afbreekt niet of gebrekkig werkt. Het gevolg is dat het glycogeen zich ophoopt in je spierweefsel. Werkt het helemaal niet, dan sterven kinderen die ermee geboren worden vaak nog voor ze één jaar oud zijn.
Voor SCID leek beenmergtransplantatie soms een goede oplossing, omdat het donor-beenmerg dan gezonde afweercellen kan aanmaken, maar het vinden van geschikte donoren, het risico op afstoting en het overlijden aan de behandeling waren grote risico’s. Bij Pompe is een middel op de markt dat de taak van het eiwit overneemt, maar dat middel is erg duur, moet je je leven lang blijven slikken, en is voor de ernstigste patiënten onvoldoende effectief.
Eleganter is om het DNA van de patiënt repareren. Dat is wat gentherapie beoogt: eerst wordt gezocht welk deel van het DNA codeert voor het defecte eiwit. Dat stukje DNA, maar dan met de juiste code, halen de onderzoekers uit donor-DNA. Dat stukje DNA, dat de patiënt zelf mist, wordt in de juiste celkernen bij de patiënt ingebouwd. Het gevolg is dat de patiënt voortaan zelf het goede eiwit aanmaakt.
Echt genezen
Het is eenvoudig gezegd, maar gentherapie bleek een ontwikkeling met veel uitdagingen. “Er zijn verschillende manieren om het voor elkaar te krijgen. In Nederland gebruikten we een methode met virussen om het DNA in de cel te krijgen. Sommige virussen kunnen dat namelijk van nature al erg goed”, zegt emeritus hoogleraar Gerard Wagemaker van de Erasmus Universiteit in Rotterdam. Hij stond aan de wieg van een behandeling van SCID met behulp van een beenmergtransplantatie, en was jarenlang voorzitter van de Nederlandse Vereniging voor Gen- en Celtherapie.
In het lab werkte de methode met virussen goed, maar bij de eerste proefpersonen ging het mis. Van de eerste twintig patiëntjes met SCID die begin deze eeuw met retrovirussen werden behandeld, ontwikkelden er zes leukemie. Wagemaker: “We hadden al na een paar weken door wat er mis ging: de virussen bouwden het DNA in naast genen die daardoor tot expressie kwamen. Enkele van die naastliggende genen veroorzaakten kanker.” Van de zes patiëntjes die leukemie ontwikkelden, werden er vijf met succes behandeld. Eén overleed. Daardoor kreeg gentherapie het imago van een technologische ontwikkeling ‘met problemen’. “Het heeft indertijd het vertrouwen in gentherapie een gevoelige klap toegebracht”, zegt Wagemaker.
Maar er verstreken sindsdien vijftien jaar. De retrovirussen die als vehikel werden gebruikt, maakten bij SCID plaats voor HIV-virussen, waaruit de onderzoekers zorgvuldig alle ziekteverwekkende elementen verwijderden. De manier waarop DNA in de celkern wordt ingebouwd, is verfijnd. “Ons genoom is een chaos. Als je een gen uit z’n context haalt, werkt het niet goed. Dat hebben we ervan geleerd. Dus je moet vaak een nieuwe promoter aan het in te bouwen gen plakken, en proberen te bevorderen dat het op een heel specifieke plaats wordt ingebouwd.” Kwamen de nieuwe genen aanvankelijk dus nog verkeerd terecht, nu worden ze toegevoegd op een plek waar ze op een goede manier kunnen doen wat ze moeten doen: het eiwit produceren zodat de patiënt kan genezen.
Torenhoge zorgkosten
Inmiddels worden voor tien relatief veel voorkomende erfelijke aandoeningen de behandelmethoden voor het eerst getest op patiënten. Maar Wagemaker is pessimistisch als het gaat om therapieën voor minder vaak voorkomende aandoeningen. Wat zich wreekt, is dat erfelijke aandoeningen erg zeldzaam zijn. Voor de farmaceutische industrie is het een afweging hoeveel mensen aan een aandoening lijden, afgezet tegen wat het kost om een therapie te ontwikkelen. Wagemaker: “Een medicijn wordt pas economisch rendabel als een ziekte vaak genoeg voorkomt. Dat is, ongeveer, op z’n laagst, bij een incidentie van één op de 200.000, maar één op 50.000 ligt misschien meer voor de hand.”
Dat halen de meeste erfelijke aandoeningen bij lange na niet. Maar al zijn die aandoeningen stuk voor stuk zeldzaam, het zijn er wel 7.559. En vele kleine beetjes maken ook een berg. Eén op de zestien Nederlanders heeft een erfelijke aandoening of de kans dat die op latere leeftijd tot expressie komt. Wagemaker: “Levenslange behandeling met soms peperdure medicijnen leidt ertoe, dat naar schatting twintig procent van onze zorgkosten opgaan aan erfelijke ziektes, waaraan dus steeds maar enkele tientallen of honderdtallen patiënten in Nederland lijden.”
Wagemaker heeft een crue verklaring waarom erfelijke aandoeningen onderbelicht zijn. “Iedereen heeft wel een familielid dat is overleden aan kanker, of eraan lijdt. En anders in je directe omgeving wel. Maar veel erfelijke aandoeningen leiden tot enorm intensieve zorg of retardatie. Die mensen belanden in specifieke zorginstellingen. Dat maakt ze onzichtbaar.” Voeg daarbij, dat er geen landelijk register is voor erfelijke aandoeningen. Dat is er bij kanker wel, waardoor de cijfers veel meer voor zich spreken. Bovendien, stelt hij, blijft een deel ongediagnosticeerd.
In de Verenigde Staten werd een paar jaar geleden een test op SCID opgenomen in de hielprik. De incidentie schoot een factor vijf omhoog. “Tachtig procent van de patiëntjes was voorheen dus over het hoofd gezien.” In Nederland komt SCID zo weinig voor, dat een arts er niet meteen aan denkt. Wat zich meestal als eerste openbaart, zijn verkoudheidsklachten bij een pasgeborene. Bij SCID werkt het immuunsysteem immers niet. Wagemaker: “Zo’n kindje komt bij de huisarts of op de eerste hulp met verkoudheidsklachten. Het wordt meestal weer naar huis gestuurd met het advies om drie dagen later terug te komen als de klachten niet minder worden. Maar drie dagen later is dat kindje dood.”
Niet rendabel
De onzichtbaarheid, de hoge prijs van symptoombestrijdende geneesmiddelen, de levenslange noodzaak van behandeling, en vaak noodzakelijke woningaanpassingen maken dat een relatief klein aantal patiënten toch één vijfde van het nationaal zorgbudget nodig hebben. Wagemaker: “Een gentherapie ontwikkelen en naar de kliniek brengen kost drie tot vijf miljoen euro. Je moet het juiste virus vinden, het geschikt maken om als transporteur te dienen, het gen ontwikkelen dat je wilt laten inbouwen, mét de juiste promoter. Maar het meeste geld gaat nog zitten in het voldoen aan de strenge regels van good medical practice. Die regels zijn bedoeld om de patiënt te beschermen, maar werken bij erfelijke aandoeningen enorm stagnerend. Bij een ziekte als Pompe kost het een miljard euro om alle patiënten in Nederland tien jaar in leven te houden. Maar toch is die drie tot vijf miljoen euro om ze te genezen niet te vinden.”
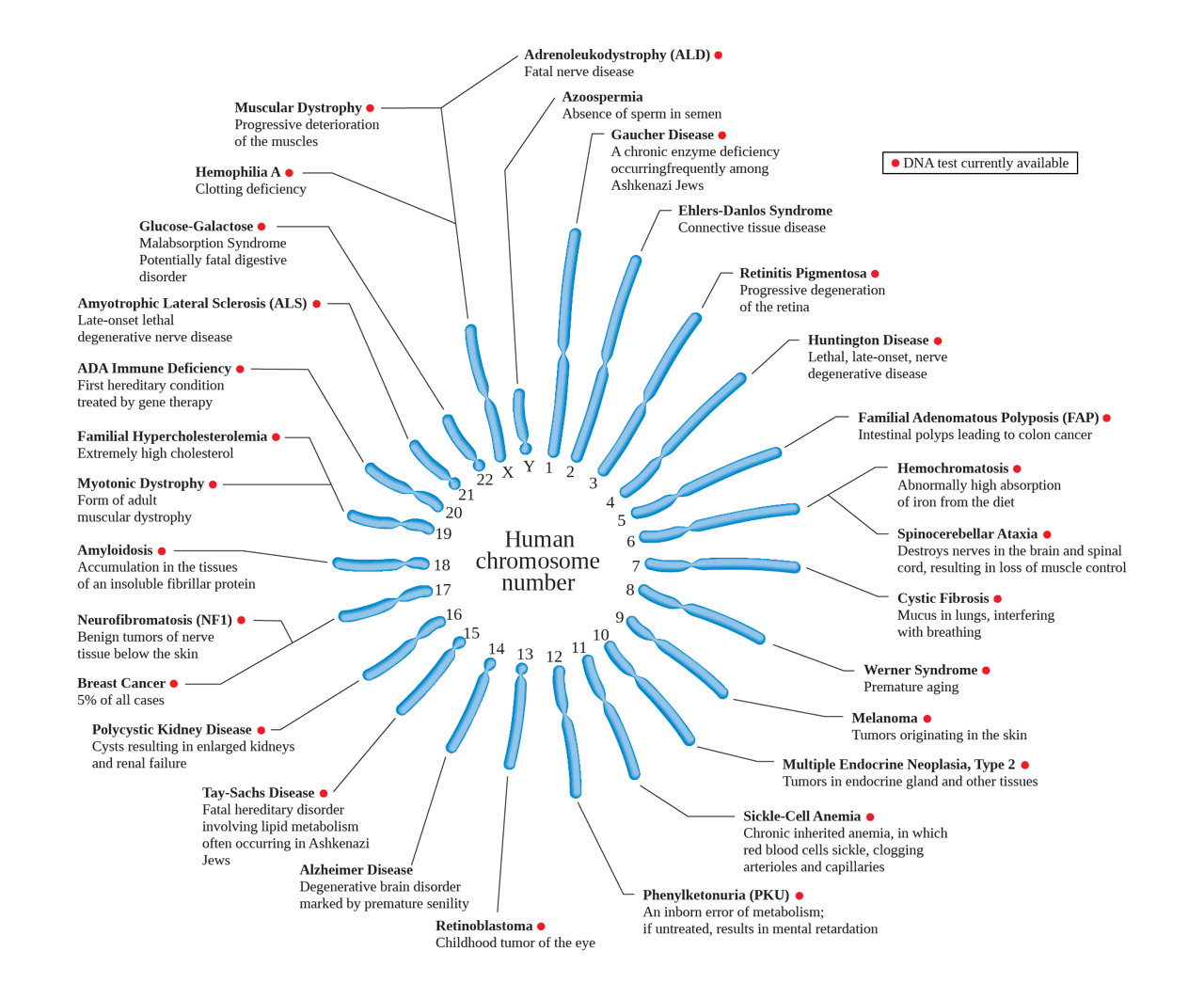
Defecten komen bij alle chromosomen voor. Het leidt tot meer dan 7.500 erfelijke aandoeningen. Dit is dus een ‘topje van de ijsberg’-overzicht van relatief veel voorkomende aandoeningen.
Ігор Пєтков, vrijgegeven in het publieke domein via Wikimedia CommonsDe farmaceutische industrie wil uiteindelijk geld verdienen met wat ze ontwikkelt. Maar voor winst zijn er te weinig patiënten. Vorig jaar staakte farmaceut uniQure nog de ontwikkeling van Glybera, een gentherapie die goed leek te helpen tegen lipoproteïnelipasedeficiëntie: een erfelijke aandoening die leidt tot terugkerende ontstekingen van de alvleesklier. Eén op de miljoen mensen heeft de ziekte. Toen uniQure er niet in slaagde om de therapie in de Verenigde Staten goedgekeurd te krijgen, en in Europa de eisen aan de klinische test steeds werden aangescherpt, gooide uniQure de handdoek in de ring, hoewel de resultaten veelbelovend waren.
Regels versoepelen
Vanuit het wetenschappelijk onderzoek kun je het ook niet verwachten, denkt Wagemaker. “Het onderzoek moet het juist met steeds minder geld doen onder ongunstige voorwaarden. Europa financiert wel onderzoek, maar een voorwaarde is nu dan meestal dat er ook een commerciële partij in het onderzoeksconsortium plaatsneemt. En die commerciële partijen aarzelen bij erfelijke aandoeningen.”
Maar hoe moet het dan wel? Wagemaker vindt dat de overheid beter zou kunnen sturen. Enerzijds door geld vrij te maken om de therapieën te ontwikkelen, anderzijds door de regels voor klinische trials bij gentherapie te versoepelen. “Als je de regels versoepelt maar tegelijkertijd wel een streng vergunningenbeleid opzet, voorkom je dat iedereen een eigen therapie in elkaar knutselt, maar maak je die therapieën wel een stuk haalbaarder. Met de huidige stand van de wetenschap kun je voor de helft van de lysosomale stapelingsziekten binnen vijf jaar een therapie ontwikkelen. De kennis is er.”

