Mannen en vrouwen zitten niet hetzelfde in elkaar en reageren daarom soms verschillend op een medicijn. Het grootste deel van de geneesmiddelen die we vandaag de dag gebruiken, is echter enkel getest op mannen. Vrouwen kunnen daardoor onverwachte bijwerkingen krijgen. Hoe komt het dat vrouwen zo slecht vertegenwoordigd zijn in geneesmiddelenonderzoek? En waar ligt de oplossing?
Vrouwen gebruiken meer medicijnen dan mannen, de verdeling is ongeveer 60/40. Van de meeste pilletjes die we op dit moment meenemen uit de apotheek is het patent al verlopen. Ze zijn tientallen jaren geleden ontwikkeld en getest. Dat testen gebeurde destijds vooral op jonge, blanke mannen.

Vrouwen gebruiken meer medicijnen dan mannen, maar toch zijn de meeste geneesmiddelen die we vandaag de dag gebruiken uitsluitend getest op mannen.
Flickr.com, Taston via CC BY-ND 2.0Beschadigd geboren
Dat heeft voor een belangrijk deel te maken met het Softenon ® drama in de jaren zestig. Softenon ®(thalidomide) werd in 1957 op de markt gebracht door een Duitse farmaceut als slaapmiddel, pijnstiller en medicijn tegen zwangerschapsbraken. Veel zwangere vrouwen slikten Softenon tegen de misselijkheid, totdat duidelijk werd dat dit zeer schadelijke effecten had.
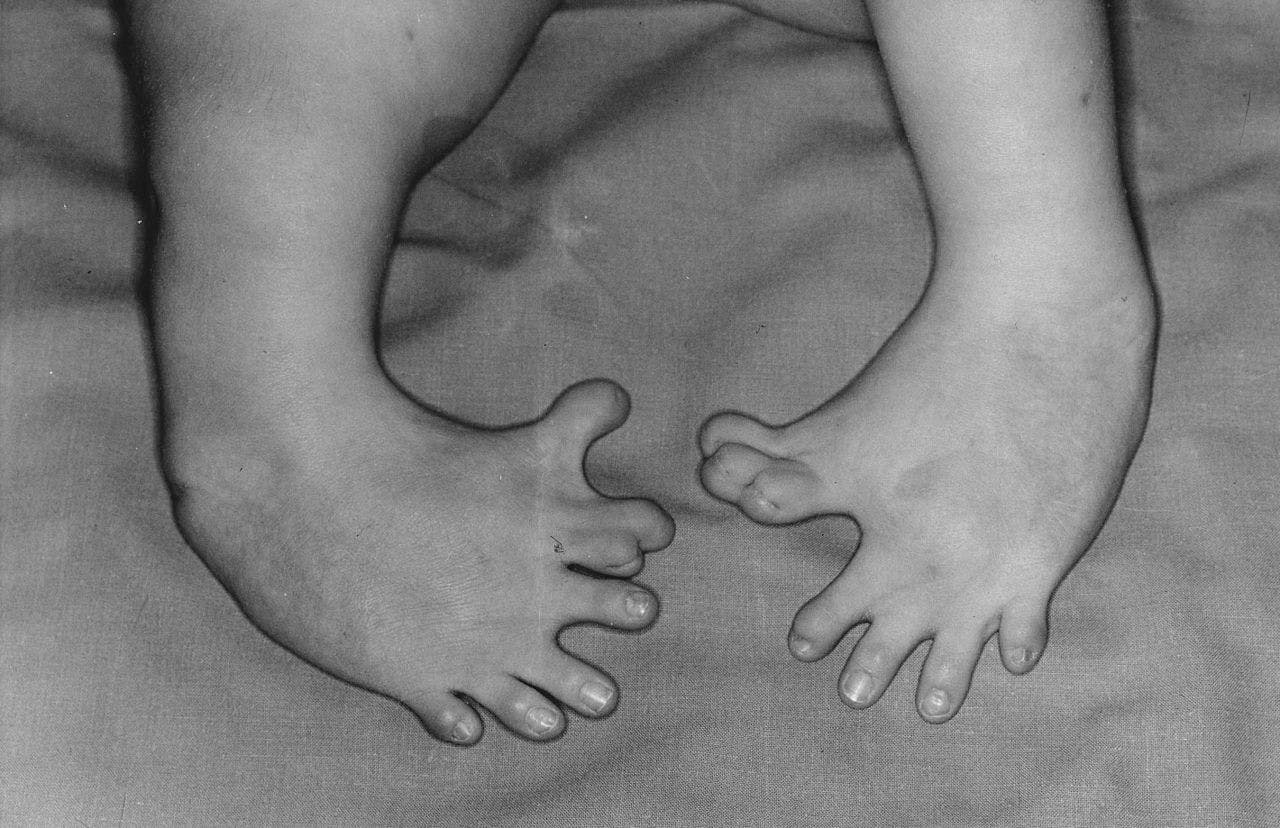
Misvorming van de voeten, veroorzaakt door thalidomide.
Wikimedia CommonsBij de Softenon® gebruiksters werden opvallend veel kinderen geboren met ontbrekende of onderontwikkelde ledematen. Het duurde tot het eind van 1961 voordat een Duitse arts voor het eerst een verband legde tussen het medicijn en de afwijkingen bij de pasgeborenen. Niet lang daarna bevestigde een Australische gynaecoloog dit verband. Afwijkingen bleken onvermijdelijk als een vrouw Softenon ® gebruikte in het eerste trimester van de zwangerschap.
Veel landen haalden het middel na deze conclusie direct van de markt. In de tijd dat Softenon ® in omloop is geweest, zijn bijna tienduizend kinderen beschadigd geboren. Om dat in de toekomst te voorkomen, zijn de eisen waar kandidaatgeneesmiddelen aan moeten voldoen toen aangescherpt. Eerst een duidelijke rapportage over de werkzaamheid en veiligheid en pas dan mag een medicijn verkocht worden.
Kleine, dikke mannen
“De eisen werden dus aangescherpt, maar tegelijkertijd werd het vrouwen min of meer verboden om mee te doen aan de vroege fasen van geneesmiddelenonderzoek”, vertelt Helle Brit Fiebrich, internist farmacoloog bij het Radboudumc in Nijmegen. “Geneesmiddelenonderzoek verloopt in drie belangrijke fasen. In de eerste fase wordt vooral gekeken naar de veiligheid en eventuele bijwerkingen van een nieuw medicijn. Dit gebeurt in kleine groepen gezonde proefpersonen. In de tweede fase wordt de werkzaamheid van het geneesmiddel getest in patiënten. En in de derde fase wordt het nieuwe medicijn vergeleken met een placebo.”

Een scheikundige van de Amerikaanse FDA buigt zich over de aanvraag voor de registratie van een nieuw geneesmiddel.
Wikimedia CommonsBehalve dat vrouwen dus werd afgeraden om mee te doen (in de Verenigde Staten was dit zelfs wettelijk verboden), hadden producenten dat liever ook niet. Vrouwen zijn namelijk niet zo’n makkelijk onderzoeksobject als mannen. “Om het even kort door de bocht te zeggen: vrouwen zijn kleine, dikke mannen met slechte nieren die depressief zijn”, grapt Fiebrich. Vrouwen hebben last van hormoonschommelingen die van invloed kunnen zijn op de werking van een medicijn. “Ze beïnvloeden bijvoorbeeld de werking van enzymen in de lever, die nodig zijn voor de afbraak van een geneesmiddel. Dit merk je het sterkst in de zwangerschap, maar kan ook een rol spelen in de overgang”, gaat Fiebrich verder.
Een laatste reden dat producenten liever geen vrouwen in hun testgroep hebben, is dat de individuele verschillen tussen vrouwen groter zijn dan tussen mannen. Om een duidelijk resultaat te krijgen, heb je bij vrouwen dus een grotere groep nodig dan bij mannen. Daardoor stijgen de kosten van de ontwikkeling van een medicijn. Fiebrich vindt het kostenplaatje geen goed argument. “De kosten voor de ontwikkeling van een medicijn liggen meestal rond de twintig procent. Dit ligt bijvoorbeeld nog onder de kosten voor marketing, waar ongeveer dertig procent naartoe gaat.” Het grootste deel van het geld gaat naar de productie. “Voor de ontwikkeling kan er dus nog best wat geld bij”, stelt zij.

Vrouwen zijn niet zulke makkelijke proefpersonen als mannen. Bij vrouwen zijn er meer individuele verschillen, waardoor er grotere testgroepen nodig zijn.
Pixabay, Clker-Free-Vector-Images, CC0Consequenties
De gevolgen van het jarenlang uitsluitend testen op mannen zien we nu in de praktijk. Loes Visser, hoofddocent farmaco-epidemiologie aan het Erasmus MC Rotterdam, deed onderzoek naar het verschil in ziekenhuisopname tussen mannen en vrouwen. Zij zag onder meer dat vrouwen die bloeddrukverlagers slikten vier keer vaker in het ziekenhuis werden opgenomen dan mannen die hetzelfde medicijn gebruikten. “We hebben vijf jaar aan data van alle ziekenhuisopnamen in Nederland, maar daar zitten geen individuele data bij, dus we weten onvoldoende wat de reden was voor een opname”, vertelt ze. “Dit onderzoek vormt dus een aanwijzing. Vervolgonderzoek dat op kleinere schaal meer de diepte ingaat, moet uitwijzen hoe de vork echt in de steel zit.”
Hartziekten ontwikkelen zich bij vrouwen anders dan bij mannen. Vrouwen zijn op het moment dat zij een hartinfarct krijgen vaak een paar jaar ouder dan mannen, ze hebben vaker suikerziekte en vaak een veel hogere bloeddruk. Mannen hebben meestal een voorgeschiedenis met infarcten, vrouwen met hartfalen.
Stichting Biowetenschappen en MaatschappijOok Eric Boersma, hoogleraar klinische epidemiologie van hart- en vaatziekten aan het Erasmus MC Rotterdam, heeft ervaring met verschillen tussen mannen en vrouwen. Hij deed in de jaren negentig onderzoek naar antistollingsmiddelen. “Vroeger werd er na een hartinfarct niet meteen gedotterd, maar werd het even aangekeken”, vertelt hij. “Patiënten kregen dan antistollingsmiddelen, medicijnen die stolling tegengaan en zo de schade van een hartinfarct beperken.”
“In de jaren negentig hebben we zes studies gepoold met in totaal dertigduizend proefpersonen, waarvan zevenduizend vrouw. Toen bleken de middelen bij mannen beschermend te werken (een twintig procent reductie op verdere schade), terwijl ze bij vrouwen juist beschadigend werken (een vijftien procent toename van de schade).” Een verklaring voor het verschil werd niet gevonden, maar de resultaten hadden wel gevolgen. Tegenwoordig wordt er na een hartinfarct gelijk gedotterd. “In dit geval heeft een verschil tussen mannen en vrouwen dus ook consequenties voor de mannen”, zegt Boersma. “Zij worden nu ook standaard gedotterd, terwijl een behandeling met antistollingsmiddelen wellicht prima had kunnen werken.”
Big data
Inmiddels doen in fase twee en drie van geneesmiddelenonderzoek ongeveer evenveel vrouwen mee als mannen. Alleen fase een blijft achter. Daar ligt het percentage deelnemende vrouwen rond de dertig procent. Producenten die nu een medicijn ontwikkelen, worden dan ook verplicht het middel te testen in een groep waarvoor het geneesmiddel uiteindelijk bedoeld is. Een probleem blijft dat consumenten alleen op de hoogte worden gebracht van de overall behandeleffecten. Verschillende effecten bij mannen en vrouwen worden bijna nooit gerapporteerd.
Het gaat dus beter, maar het blijft lastig om alles te testen. Visser: “We kunnen nooit alle diversiteiten meenemen in geneesmiddelenonderzoek.” Tachtig procent van de zwangere vrouwen neemt bijvoorbeeld weleens een pilletje tijdens de zwangerschap en als je ziek bent, is dat soms ook niet te vermijden. Maar zwangere vrouwen zitten nooit in klinische trials, dus er is weinig kennis over het effect van medicijnen voor de zwangere vrouw en het ongeboren kind.

Zwangere vrouwen worden niet meegenomen in geneesmiddelenonderzoek. Voor het ongeboren kind is het namelijk nooit een vrije keus om mee te werken aan dat soort onderzoek.
Flickr Edwin & Kelly Tofslie, CC BY 2.0In zo’n geval kan het nuttig zijn om achteraf te kijken naar bijwerkingen. Dat kan ook een goede tactiek zijn bij ‘oude’ medicijnen die nog uitsluitend op mannen zijn getest. Huisartsen en ook particulieren kunnen in Nederland hun bijwerkingen melden bij bijwerkingencentrum Lareb. Agnes Kant, directeur van Lareb: “We hebben nu twintig jaar aan data en beginnen ons steeds meer te richten op de vraag ‘wie krijgt een bepaalde bijwerking en waarom?’ Een voorbeeld zijn antidepressiva met de bijwerking hoest. Dat werd bij ons zesentwintig keer gemeld, waarvan drieëntwintig keer door vrouwen. Dan weet je dat er iets bijzonders aan de hand is en ga je daarnaar kijken.”
Boersma is voorstander van het gebruik van big data. Instanties zoals Lareb zouden daarin een belangrijke rol kunnen spelen. “Veel studies zijn op zichzelf te klein om effecten op te merken. Je hebt echt grote databestanden nodig om de verschillen tussen mannen en vrouwen te achterhalen”, zegt hij. En dat gebeurt nu ook. Zo gaat Lareb, met een subsidie van de Nederlandse organisatie voor gezondheidsonderzoek en zorginnovatie ZonMw, bijvoorbeeld onderzoek doen naar alle bijwerkingen die door zwangere vrouwen bij hen gemeld worden.