Wetenschappers van de Katholieke Universiteit Leuven maakten een vaccin op basis van afweercellen en dood tumorweefsel. Dat vaccin weet muizen met een hersentumor langdurig in leven te houden. In combinatie met chemotherapie werkt het vaccin zelfs genezend. De wetenschappers hopen hun resultaten snel te kunnen vertalen naar een werkzaam vaccin voor kankerpatiënten.
Onderzoeker Stefaan van Gool (KU Leuven) ontwikkelde samen met zijn collega’s een vaccin op basis van afweercellen en dood tumorweefsel. Het tumorweefsel dient als ‘aas’ om het afweersysteem in werking te zetten.
Het vaccin van de Belgen is gebaseerd op specifieke afweercellen, de dendritische cellen. Van Gool vertelt: “Dendritische cellen zijn de stofzuigers van ons lichaam. Ze maken het lichaam schoon. Maar op het moment dat ze een gevaar detecteren, gaan ze ineens ander werk doen. Dan gaan ze de gevaarlijke stukjes die ze hebben opgezogen aan de rest van het afweersysteem laten zien.” Pas op het moment dat dendritische cellen een gevaar detecteren, kan de rest van het afweersysteem aan de slag om de bedreiging op te ruimen.
Compleet tumorweefsel
Gevaarsignalen bepalen wanneer een dendritische cel de omslag maakt van stofzuiger naar presenterende cel. Zulke gevaarsignalen worden bijvoorbeeld geïnduceerd door beschadigingen of wondjes in het lichaam, infecties, of oxidatieprocessen waarbij vrije radicalen (moleculen die erg reactief zijn, omdat ze een vrije bindingsplaats hebben) ontstaan.
Bij het maken van een kankervaccin is het belangrijk dat er genoeg gevaarsignalen vrijkomen om de dendritische cellen een omslag te laten maken. En dat was tot nu toe problematisch. “De meeste onderzoekers gebruiken twee, drie of vijf specifieke tumorantigenen, moleculen die in staat zijn om een afweerreactie tegen de tumor op gang te brengen. Selectie zorgt ervoor dat de tumor die specifieke antigenen na een tijdje niet meer laat zien”, legt van Gool uit. “Wat wij nu hebben gedaan, is het complete tumorweefsel gebruiken. Daarin zitten alle tumorantigenen, zowel degene die we kennen als degene die we niet kennen.”
Bevriezen en ontdooien
Het vaccin bestaat uit dendritsche cellen, geladen met dood tumorweefsel. Tumorweefsel wordt gedood door het herhaaldelijk te bevriezen en te ontdooien. De tumorcellen spatten uit elkaar en de dendritische cellen kunnen de dode tumorfragmenten opzuigen. De bewerking van het tumorweefsel (ontwikkeld door onderzoekers Patrizia Agostinis en Abhishek Garg) maakt dat er veel vrije radicalen vrijkomen. Deze dienen als gevaarsignaal en dus schieten de dendritische cellen na het opzuigen van de tumorfragmenten gelijk in hun presenterende rol.
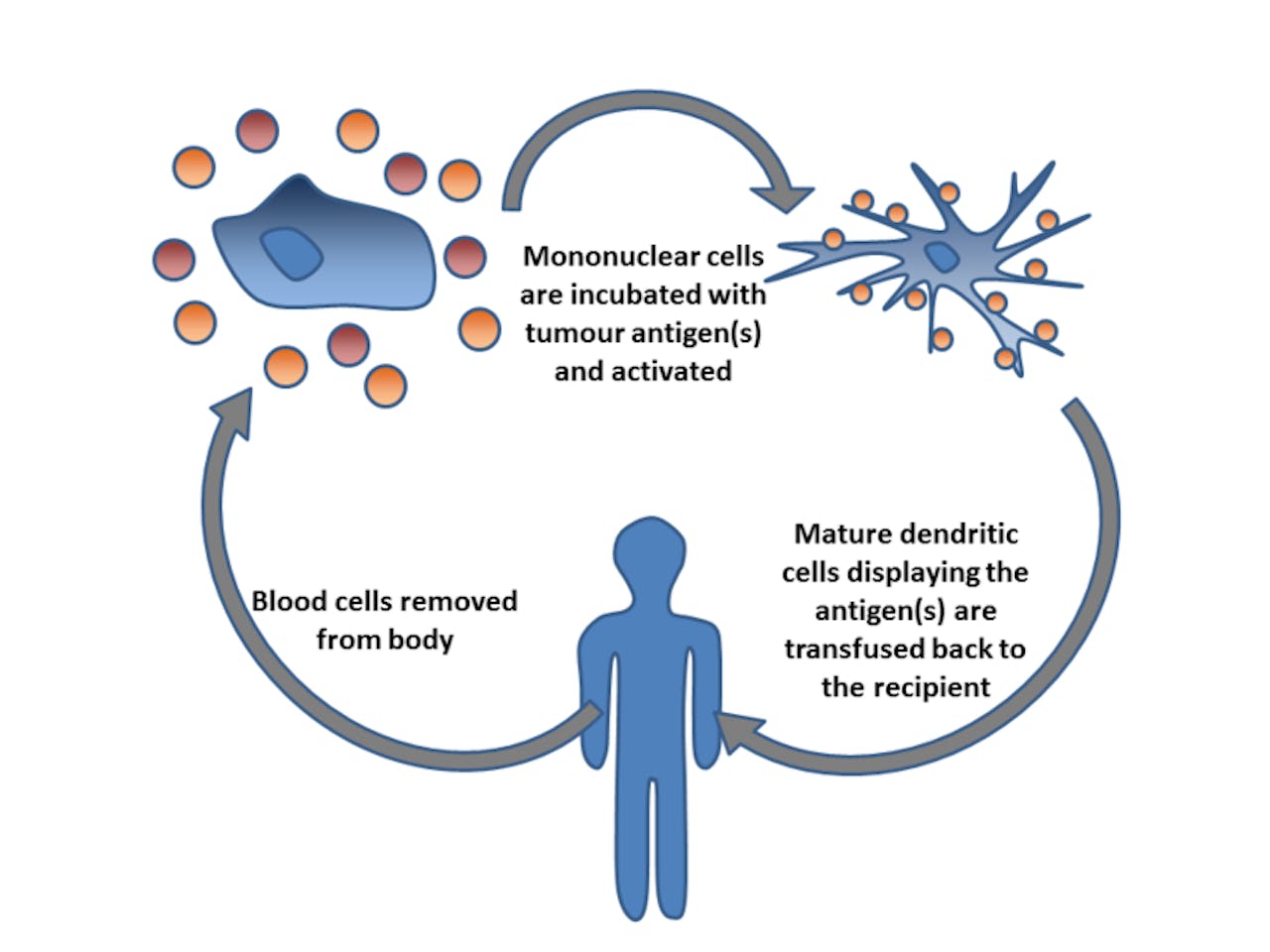
Eenvoudige weergave van het idee van therapie met dendritische cellen. Eerst worden bloedcellen uit het lichaam van de patiënt gehaald. In het bloed zitten voorlopercellen. Die voorlopercellen worden in het laboratorium behandeld met dood tumorweefsel. Daardoor vormen de voorlopercellen zich om tot actieve dendritische cellen. Deze actieve dendritische cellen, die de antigenen van het tumorweefsel aan het afweersysteem laten zien, worden teruggeplaatst bij de patiënt.
Simon CaultonLangdurige overlevers
Van Gool en zijn collega Lien Vandenberk testten het vaccin bij muizen. Op dag nul van het experiment werd bij 39 muizen een dodelijke dosis hersentumorcellen ingespoten. Vijf muizen vormden de controlegroep en werden niet verder behandeld. Twaalf muizen kregen in twee weken tijd drie maal een dosis vaccin toegediend. Vijf muizen werden binnen drie weken zes keer behandeld met chemotherapie. De overige zestien muizen kregen ook chemotherapie, aangevuld met drie maal een dosis vaccin.
Het vaccin op zich werkt niet genezend, maar in combinatie met chemotherapie zorgt het voor langdurige overleving bij muizen.
NIHVan Gool: “Wat we zagen is dat het vaccin op zich niet genezend werkt, al verlengt het de gemiddelde levensduur van muizen wel met ongeveer tien dagen. Maar in combinatie met chemotherapie overleeft de helft van de muizen langdurig (drie keer zo lang als de gemiddelde overlevingsduur zonder behandeling). Die langdurige overlevers hebben we opnieuw ingespoten met tumorcellen. Bij ongeveer dertig procent van de muizen zorgde dat voor afstoting. Er ontstaat dus ook echt een immunologisch geheugen tegen de tumorcellen.”
Hoogste aantal levensjaren
De onderzoekers proberen hun resultaten nu te vertalen naar een nieuwe generatie vaccins voor patiënten. Waarschijnlijk gaat de eerste klinische test plaatsvinden in het IOZK in Keulen, bij uitbehandelde patiënten met een hersentumor. “We werken nu aan deze vorm van kanker, omdat die tussen alle kankers het hoogste aantal levensjaren opeist. Patiënten krijgen het al op relatief jonge leeftijd en overleven bijna nooit”, zegt van Gool.
“Maar in principe is deze aanpak geschikt voor verschillende vormen van kanker, zolang er maar tumorantigenen zijn. Hoe meer mutaties (genetische veranderingen) een tumorcel oploopt, hoe meer antigenen er zijn. Ook bijvoorbeeld huidkanker, longkanker, borstkanker, prostaatkanker, eierstokkanker en nierkanker zijn geschikt voor immuuntherapie.”
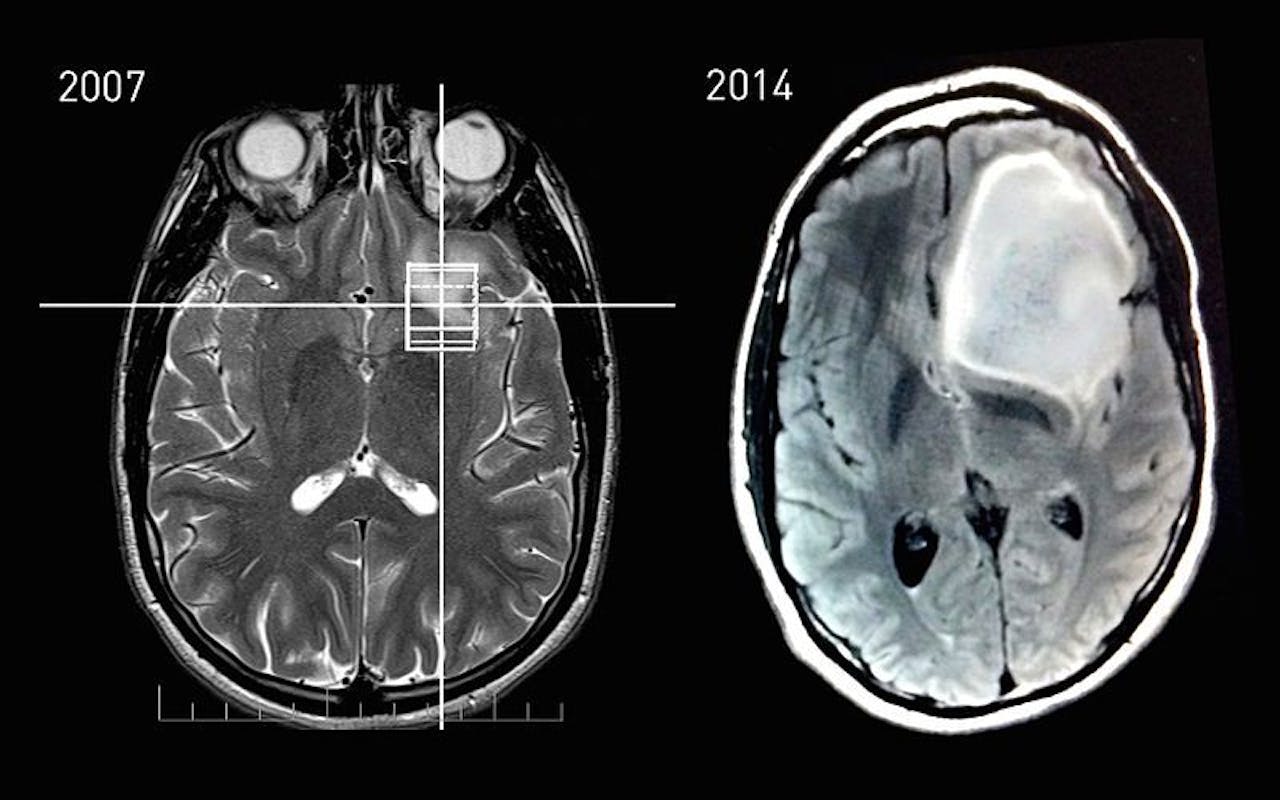
Groei van een hersentumor, zichtbaar gemaakt met behulp van MRI.
Steven KeatingDeel van het probleem
Bij het maken van een werkzaam kankervaccin spelen een aantal problemen. Van Gool: “Ten eerste moeten we nog veel leren over de biologie van dendritische cellen, zowel in een gezond lichaam als bij ziekte. Daarnaast weten we nog niet precies hoe we het afweersysteem zo ver kunnen krijgen dat het de tumor aan gaat pakken. En als laatste weten we niet welke tumorantigenen het beste in een vaccin gebruikt kunnen worden.” Dit hebben de Belgen nu opgelost door het complete tumorweefsel in het vaccin te stoppen. Maar of het oplossen van dit deel van het probleem voldoende is voor een effectieve nieuwe behandeling tegen kanker, moet in de komende jaren blijken.