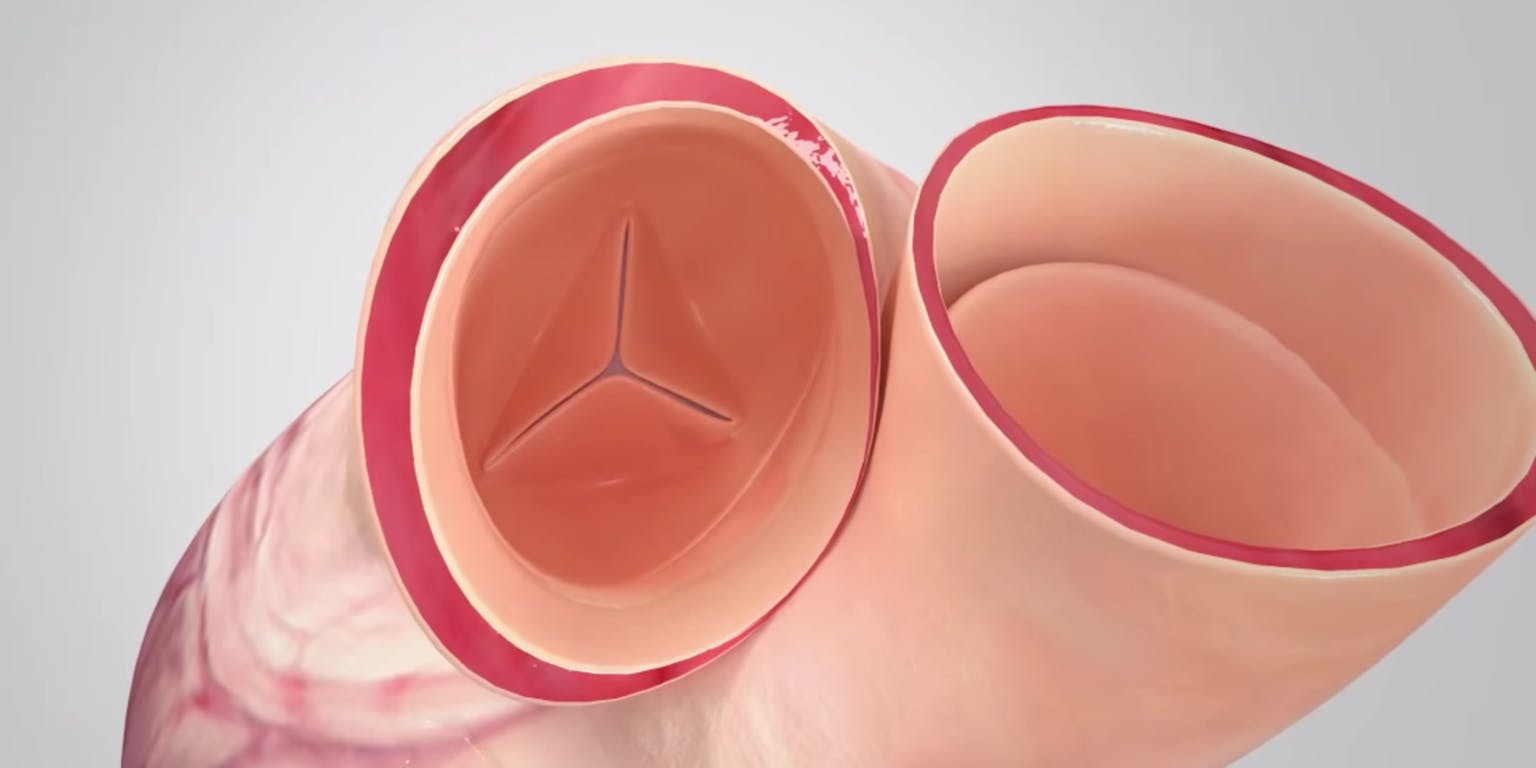
Mensen met een lekkende of vernauwde hartklep kunnen een vervangende kunstklep geïmplanteerd krijgen. Maar kunsthartkleppen zijn niet ideaal. Carlijn Bouten werkt aan een alternatief: een implantaat dat na plaatsing lichaamseigen cellen aantrekt en daarvan zelf een nieuwe hartklep vormt.
Een nieuw soort implanteerbare hartklep die lijkt op een echte klep is hard nodig. De kunstmatige exemplaren die nu worden gebruikt voor implantatie hebben namelijk behoorlijk wat nadelen.
Carlijn Bouten, hoogleraar Biomedische technologie aan de Technische Universiteit Eindhoven legt uit: “Een mechanische prothese leeft niet. Die is gemaakt van kunststof en metaal, en kun je horen tikken. Wat erger is: deze kleppen slaan de bloedlichaampjes kapot. Je moet daarom je leven lang medicijnen slikken tegen trombose. Maar met zulke bloedverdunners zijn bloedingen lastig te stoppen. Kortom: de kwaliteit van leven gaat voor een patiënt wel omhoog, maar eigenlijk krijg je een aandoening erbij.”
Een biologische klep van een donor(dier) is evenmin ideaal, omdat je die na zo’n vijftien jaar moet vervangen. Voor jonge patiënten betekent dat een reeks risicovolle operaties, want voor deze groep – zesduizend Europese kinderen per jaar hebben een nieuwe hartklep nodig – worden er geen kunstkleppen op maat gemaakt. Donorkleppen zijn bovendien schaars.
Een leven lang
Dat moet anders kunnen, dachten Bouten en collega’s. Al eerder werkten zij aan een nieuw type, in het lab opgekweekte tissue engineered kunsthartklep (zie ook In kweek: de meegroeiende hartklep). “Hartkleppen gaan honderdduizend keer per dag open en dicht. Het idee is dat levende kleppen een stuk beter functioneren. Ze slijten niet en zijn zelfherstellend. Ze passen zich aan nieuwe omstandigheden aan, bijvoorbeeld een verhoogde bloeddruk. Via tissue engineering kun je levende prothesen bouwen en we wilden dat ook voor hartkleppen doen.”
Met zo’n tissue-engineered klep, gemaakt uit lichaamseigen cellen, vang je de nadelen op van de gebruikelijke kunstkleppen: geen trombose of afstotingsverschijnselen, en levende tissue engineered kleppen kunnen meegroeien met de patiënt en een leven lang meegaan.
Hulpstoffen
Maar een in het lab gekweekte hartklep heeft ook nadelen. Het is niet duidelijk van wie de hartklep eigenlijk is: de onderzoekers, de patiënt, of de arts? Een infectie is gauw opgelopen. En bovendien: de kweek kost ruim acht weken en is erg duur. Daarom zijn de Eindhovense onderzoekers een andere weg ingeslagen: het implanteren van een levenloos raamwerk – een scaffold, in medisch jargon – dat zich in het lichaam zelf ontpopt tot een volledig functionerende hartklep.
Het principe is simpel: neem een stevig, maar poreus plastic-achtig materiaal dat in het lichaam afbreekbaar is, implanteer het, en laat het lichaam die scaffold zelf opvullen met eigen cellen. Bouten: “Het lichaam kan heel goed zelf weefsel maken. Kijk maar naar de reparatie van een wond. Een ontsteking trekt zelf cellen aan. Het enige wat je moet doen, is dat proces in goede banen leiden”. De groep van Bouten begeleidt het groeiproces, door bijvoorbeeld aan de scaffold bepaalde actieve moleculen toe te voegen die de genezing bevorderen door monocyten (een type witte bloedcel) uit het bloed aan te trekken. De cellen vormen in de mal van de scaffold dan langzaam maar zeker een sterk weefsel. Al eerder slaagden de Eindhovense wetenschappers erin om met die methode bloedvaten te vervangen.
Speciale groepen
Mechanisch lijkt de kunstklep al goed te werken. De uitdaging is om de klep in het lichaam precies het goede weefsel te laten groeien. Een hartklep moet sterk zijn, maar tegelijk flexibel. Hij moet de juiste vorm krijgen. En de afbraak van de scaffold moet niet te snel of te langzaam gebeuren. “Dat proces moeten we nog finetunen”, zegt Bouten. En dat gebeurt buiten het lichaam, in het Eindhovense lab. De scaffolds worden in een bioreactor geplaatst waarin ze worden voorzien van stromend kunstbloed, om de situatie in het lichaam zo goed mogelijk na te bootsten. Een ‘humaan modelsysteem’, noemen de onderzoekers het. Bouten: “We moeten nog veel testen. Je wilt weten hoe snel het weefsel groeit, en hoe je de afbraak van het scaffoldmateriaal aan- of uitzet. Een scaffold heeft bepaalde eigenschappen, maar als het weefsel erin groeit veranderen die. Zie het als een Ikea-test: je moet zeker weten wat de klep uiteindelijk kan en volhoudt waar die voor bedoeld is.”
Waar in het lab van Bouten de ‘in vivo-situatie’ wordt nagebootst, kun je ook de omstandigheden van een ziek of oud lichaam simuleren. Bij mensen met diabetes gaat het genezen van een wond bijvoorbeeld langzamer dan bij gezonde mensen, dus zou de leeftijd ook van invloed kunnen zijn op de bouw van de hartklep. En cellen van oude mensen hebben andere eigenschappen dan die van jonge mensen.
De scaffoldmethode biedt mogelijkheden om ook lastiger omstandigheden het hoofd te bieden, door in de scaffold extra hulpstoffen aan te brengen. Bouten en collega’s willen voor een aantal belangrijke patiëntgroepen uitzoeken welke extra’s goed werken. “Maar natuurlijk kan beschadiging van de hartklep ook opnieuw voorkomen. We moeten voor bijvoorbeeld diabetes dus bepalen of deze techniek wel of niet geschikt is”, zegt Bouten.
Schapen
De volgende halte voor deze behandeling is proefdieronderzoek. Hoewel het humaan modelsysteem in zekere zin nog complexer is dan een proefdier – je kunt er immers de situatie van een zieke patiënt mee simuleren – moet de techniek aantoonbaar werken bij proefdieren voor ze bij mensen toegepast kan worden.
De ideale kandidaat is daarvoor al gevonden: het schaap, waar eerder al in het lab gekweekte kleppen op werden getest. Die dieren zijn namelijk het worst case-scenario, vanwege de snelheid waarmee de hartklep kan verkalken. Als het lukt om in de schapen een werkende gezonde hartklep te ‘kweken’, dan zal het zeer waarschijnlijk ook bij de mens lukken.
Die laatste fase, de scaffold implanteren bij mensen met een slecht functionerende hartklep, laat nog even op zich wachten. Maar wanneer de klep twee jaar goed bij een schaap blijkt te functioneren, is voor de onderzoekers de stap naar een eerste klinische studie mogelijk.