In het midden van de vorige eeuw leek het periodiek systeem compleet. 92 verschillende elementen waren er bekend. Maar met de ontwikkeling van de atoombom kwamen er nieuwe elementen aan het licht. Nieuwe elementen bleken maakbaar in het laboratorium. Inmiddels staat de teller op 116. Hoe worden ze gemaakt en wat kunnen ze voor ons betekenen?

De versneller van het GSI.
GSI Helmholtzzentrum für SchwerionenforschungHet heeft wel iets weg van een schietoefening. De 120 meter lange lineaire versneller van het GSI Helmholtzzentrum für Schwerionenforschung (GSI) in het Duitse Darmstadt blinkt als een net opgepoetst kanon. Met dit apparaat worden zo’n biljoen projectielen per seconde afgevuurd.
De ‘kogels’ zijn chroom-ionen, het doelwit is een micrometer (miljoenste deel van een meter) dikke plaat van het radioactieve curium. Het doel is simpel: ervoor zorgen dat een van de kogels het doelwit raakt. Oftewel dat een chroom-kern in aanraking komt met de kern van een curiumatoom. Gebeurt dat met precies de goede snelheid, dan smelten de kernen samen tot een superkern waarin alle kerndeeltjes van het chroom en curium opgeslokt zijn. Met het maken van dit nieuwe element, met de voorlopige naam unbinillium (Latijns voor een-twee-nul-ium), zou een nieuw vakje van het periodieke systeem ingekleurd kunnen worden.
Het periodiek systeem in cupcakes.
University of Aberdeen Science Magazine CC1.0Althans, dat hadden de wetenschappers van het GSI in 2010 gehoopt. “We hebben een indicatie van de productie van element 120”, zegt Sigurd Hofmann, die als professor verbonden is aan het GSI. “Dat wil zeggen dat we deeltjes hebben waargenomen die na het chroom-bombardement radioactief vervallen tot lichtere elementen. Het kan zijn dat we daarmee element 120 hebben gezien, maar de vervalreeks gaf ruimte voor twijfel.”
Hofmann geeft aan dat er meer experimenten gedaan moeten worden om het bestaan van dit splinternieuwe element te bevestigen. Dat kan met de versneller in Darmstadt of in een van de enkele andere druk bezette deeltjesfabrieken in de wereld, zoals in de Verenigde Staten en Rusland.
Doelwit missen
Het lijkt vrijwel onmogelijk, maar wetenschappers schieten op de bovenstaande manier regelmatig wekenlang op een doelwit zonder ook maar één treffer te hebben. Hofmann laat weten dat vrijwel alle atomen dwars door de plaat heen vliegen. Dat komt omdat de atoomkern ten opzichte van het atoom zo ontzettend klein is. Zou je het atoom opblazen tot het formaat van een kathedraal dan is de kern ongeveer zo groot als een huisvlieg.
Maar soms is het wel raak en smelten de twee atoomkernen samen. Hofmann was tussen 1982 en 1996 betrokken bij de ontdekkingen van elementen 107 tot en met 112, die inmiddels allemaal een naam en vakje in het periodieke systeem hebben gekregen (element 110 heet officieel darmstadtium).
Omdat de kans op een succesvolle samensmelting zo klein zijn, worden er zelden grote hoeveelheden van nieuwe elementen gemaakt. Vaak berust een ontdekking op slechts van een handjevol atomen. Bovendien zijn deze nieuwkomers vrijwel allemaal een zeer kort leven beschoren. Over het algemeen geldt dat zwaardere atomen een steeds kortere halfwaardetijd hebben, wat betekent dat ze uit elkaar vallen in lichtere elementen. Elementen als curium (96) en californium (98) vervallen binnen een tijdsbestek van enkele tot honderden jaren, nog zwaardere elementen zijn zo instabiel dat ze ternauwernood het ritje naar de detector overleven. De stabielste isotoop van livermorium (116) bestaat gemiddeld 60 milliseconden.
Elementen maken én vinden
Het maken van een element valt niet mee. Je hebt er enorme apparaten voor nodig én een flinke portie geduld. “De experimenten waarmee we copernicium (112) hebben bevestigd namen ongeveer twee weken in beslag”, laat Hofmann weten. “Uiteindelijk hebben we welgeteld één atoom gedetecteerd.”
Maar als er maar zo weinig atomen worden gemaakt, hoe is deze dan te vinden tussen de rest van de atomen die dwars door de plaat zijn gevlogen? “We kunnen scheiden op basis van de massa van de atomen”, zegt Hofmann. “Dat doen we met elektrische en magnetische velden, waarin de geladen deeltjes afbuigen. Omdat deeltjes met verschillende gewichten, op verschillende manieren afbuigen kunnen ze op deze manier worden gescheiden.”
Van die afbuiging van het atoom krijgen de wetenschappers al een indicatie van de massa van het gefabriceerde atoom. “Die meting is niet heel erg precies”, zegt Hofmann. “De onzekerheid in de massa is wel tien procent, dus we hebben meer metingen nodig.”
En daarvoor wordt de korte levensduur van de nieuwe atomen benut. Superzware atomen zenden binnen de kortste keren een pakketje van twee protonen en twee neutronen uit, oftewel een alfadeeltje. Dat is te detecteren in een plaat van silicium waarin de kersverse atomen na hun productie zijn ingeslagen. Hofmann: “Zodra zo’n nieuw atoom een alfadeeltje uitzendt kunnen we dat zien als een stroompje in het silicium.”
Er is vrijwel altijd sprake van een vervalreeks waarin een element meerdere alfadeeltjes uitzendt en zo steeds lichter worden. Het wordt daarbij ook telkens een nieuw element. Uiteindelijk bereik je op die manier een stabiel en bekend element. Door vanaf dit element ‘terug te rekenen’ kan worden bepaald met welk atoom de vervalreeks is begonnen.
Eiland van stabiliteit
De zoektocht naar steeds zwaardere atomen is inmiddels beland bij element 116, dat ontzettend instabiel blijkt te zijn. Toch blijven de wetenschappers proberen om steeds zwaardere elementen te maken. Zo hopen ze uiteindelijk het zogenoemde ‘eiland van stabiliteit’ te bereiken. Een regio in de isotopenkaart waarin combinaties van bepaalde aantallen neutronen en protonen zou kunnen leiden tot stabiele kernen.
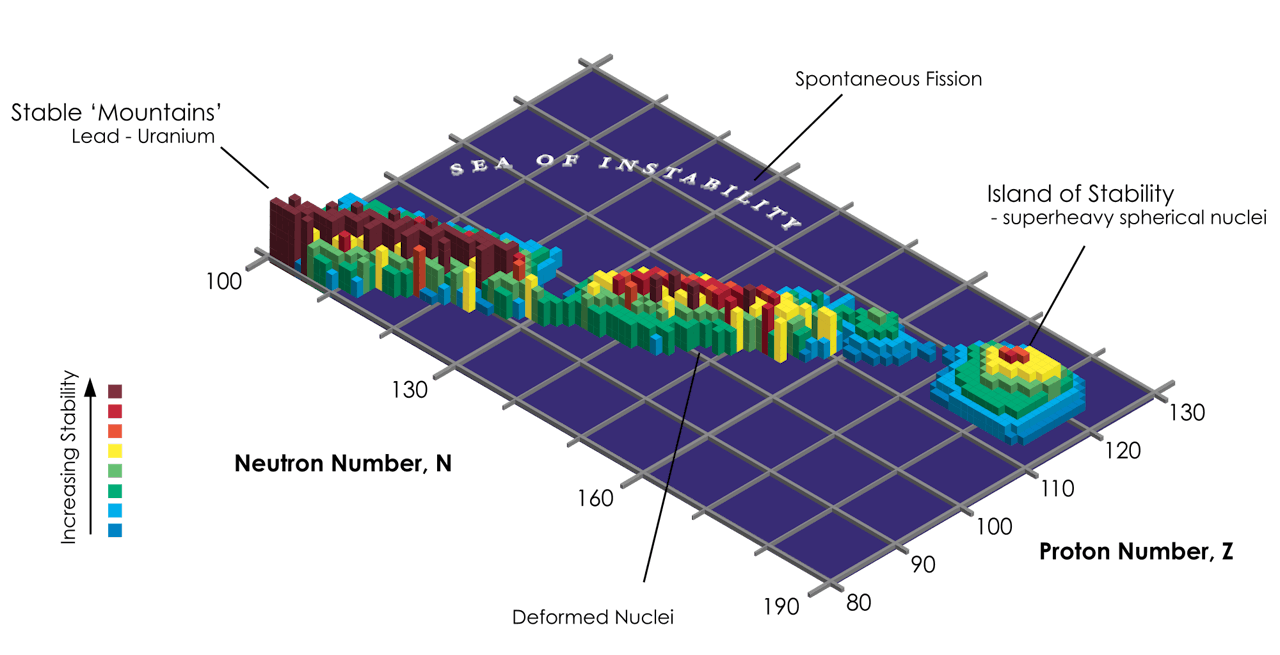
Een isotopenkaart die de stabiliteit van isotopen laat zien. Hoe hoger de staafjes des te stabieler de elementen. Het spreekwoordelijke eiland van stabiliteit ligt rechts, de ‘landtong’ (links) loopt verder door en bestaat uit alle stabiele elementen van het periodieke systeem.
InvaderXanHofmann laat weten dat de wetenschappers eigenlijk al op het spreekwoordelijke eiland van stabiliteit zijn aanbeland. Alleen bevinden ze zich als het ware op het strand en zouden ze de binnenlanden in willen. Daarvoor moeten er atomen gemaakt worden met meer neutronen in de kern die voor meer stabiliteit zouden zorgen. Maar dat is lastig. Hofmann: “We kunnen proberen om projectielen te gebruiken met veel neutronen in de kern, zoals de neutronrijke isotoop Calcium-52. Maar het is erg moeilijk om daarvan een intense bundel te maken die we met onze versneller kunnen afvuren.”
Van kernwapens tot rookmelders
De allerzwaarste elementen die nu bekend zijn kennen geen praktische toepassingen. Maar waarom dan toch verder zoeken? Ten eerste kan het fundamentele onderzoek aan zware elementen ons ook iets leren over de lichtere elementen waar wél toepassingen voor zijn. Maar wellicht vinden we op een dag ook superzware elementen die wel stabiel zijn en waar een toepassing voor gevonden wordt. Net zoals met de elementen plutonium, curium, californium en americium die hun weg respectievelijk hebben gevonden naar kernwapens, nucleaire batterijen, de medische wereld en in rookmelders.

Plutonium kan dienen in kernwapens.
United States Department of Defense, via Wikimedia Commons, publiek domeinHofmann: “Er zijn theorieën die stellen dat er zelfs rond atoomnummer 170 nog atoomkernen kunnen bestaan. Die zouden, anders dan een bol, exotische vormen hebben, zoals een donut of hol zijn. Dat blijft voorlopig nog theorie, maar ik denk dat we het op z’n minst moeten proberen om ze te maken.”


