In de natuur zijn het grote moleculen, zoals eiwitten, die belangrijke functies vervullen. Chemicus Helma Wennemers vraagt zich af of het mogelijk is om met kleinere moleculen veel van die nuttige eigenschappen te imiteren.
Wie de website van de onderzoeksgroep van Helma Wennemers bekijkt, krijgt de indruk dat ze daar van alles en nog wat doen. Wennemers, hoogleraar organische chemie aan de ETH Zürich, werkt aan metaal bevattende nanodeeltjes als kankertherapie. Maar ook aan een nieuwe klasse van katalysatoren (stoffen die chemische reacties versnellen) die interessant zijn voor de industrie om nieuwe, schonere processen te ontwikkelen en ons tegelijkertijd iets vertellen over de ontwikkeling van het allervroegste leven op aarde.
Daarnaast onderzoekt ze synthetische varianten van het eiwit collageen voor medische en elektronische toepassingen en ontwikkelt ze nieuwe stoffen om tumoren beter zichtbaar te maken. Kan ze gewoon niet kiezen? Of is er een diep verstopte rode draad die deze heel verschillende onderwerpen met elkaar verbindt? NEMO Kennislink vroeg het Wennemers tijdens chemieconferentie CHAINS, waar ze een van de sprekers was.
Je groep werkt aan zoveel verschillende onderwerpen, chemische biologie, katalyse, therapeutische nanodeeltjes…
“Oh, zet supramoleculaire chemie er ook nog maar bij (chemische reacties waarbij moleculen niet samensmelten tot een nieuw molecuul, maar alleen tijdelijk aan elkaar plakken, red.).”
Oké, ook nog supramoleculaire chemie. Maar is er een overkoepelende vraag of een groter doel?
“Ik begrijp dat je dat vraagt en ja, er is zeker een soort paraplu te spannen over al die onderzoekslijnen. Voor mij is de achterliggende vraag of een klein molecuul ook een functie kan uitvoeren waarvoor de natuur, via miljoenen jaren evolutie, juist een heel groot molecuul heeft ontwikkeld. Bij het beantwoorden van die vraag gebruiken we kleine moleculen om eigenschappen van de grote na te bootsen, waarmee we ook meteen meer leren over hoe dat grote molecuul precies werkt. Het is fundamenteel onderzoek, maar we hebben altijd wel een mogelijke toepassing in gedachten. Een toepassing waarvoor ons kleine molecuul geschikt zou zijn.”
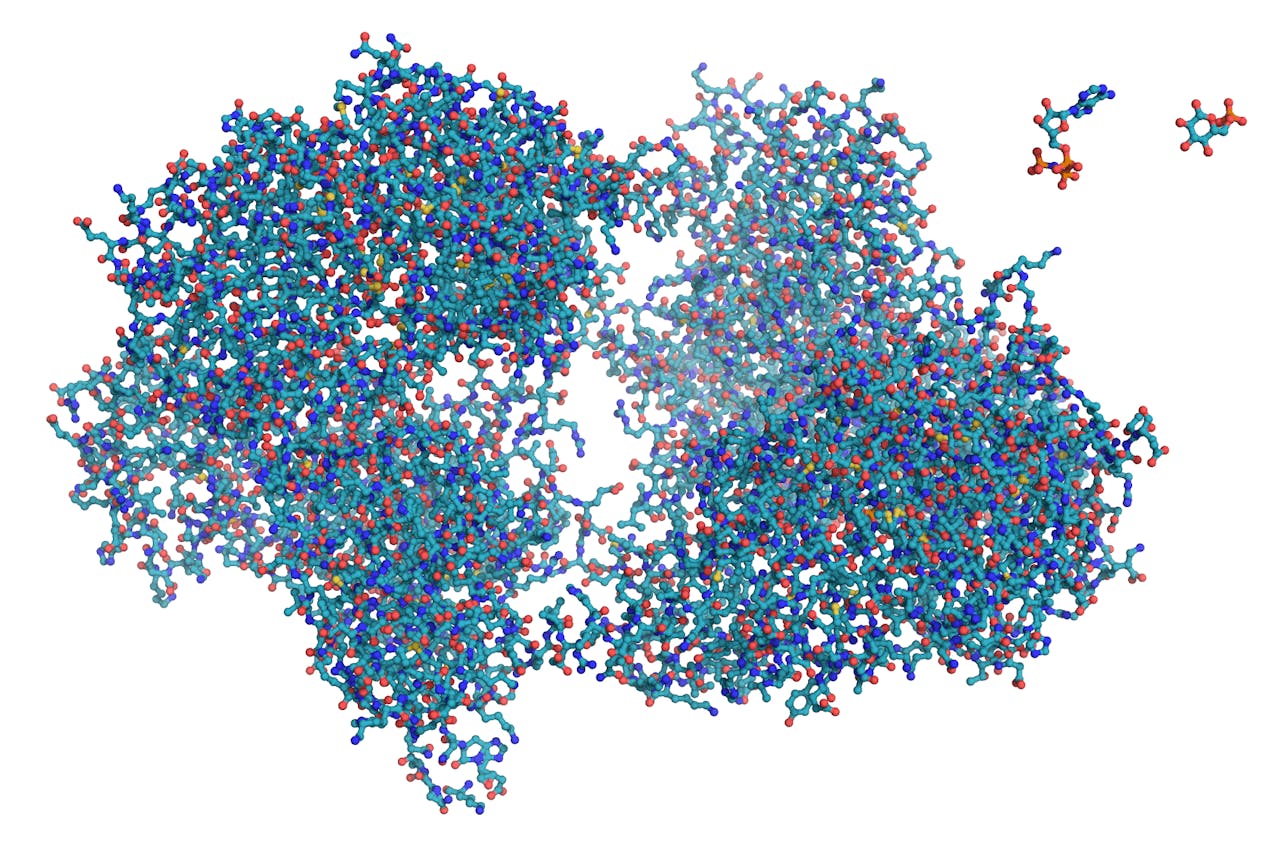
Het verschil tussen grote en kleine moleculen. Links het grote eiwit hexokinase, rechtsboven de kleine moleculen ATP (de ‘oplaadbare batterij’ van de cel) en glucose (een suiker). De peptiden waar Wennemers aan werkt behoren tot de kleine moleculen.
TimVickers via Wikimedia Commons, publiek domeinWat voor functies wil je met kleine moleculen uitvoeren?
“Een van de vragen waar wij ons al langer mee bezighouden is of peptiden (zie kader – red.) ook als katalysator kunnen werken. In de natuur zijn speciale eiwitten, de enzymen, de katalysatoren van alle processen. Ze zijn in de cel betrokken bij voor de energievoorziening, de afvalverwerking, het repareren van schade, het kopiëren van het DNA en nog veel meer. Enzymen bestaan, net als peptiden, uit aminozuren. De reden dat we naar peptiden kijken is dat ze ongelooflijk veel verschillende functies vervullen. Peptiden fungeren onder meer als hormonen, het zijn tussenproducten in de stofwisseling, ze brengen zenuwsignalen over en ze helpen bij de verdediging tegen schadelijke bacteriën. Peptiden zijn heel veelzijdig, maar toch is er dusver geen enkel peptide gevonden dat katalytische activiteit vertoont. Waarom is dat?”
Omdat die rol gaandeweg de evolutie is overgenomen door enzymen?
“Precies, het zou heel goed kunnen dat peptiden ooit de rol van katalysator hebben gehad. Enzymen zijn veel te groot en te ingewikkeld om zomaar, in een keer, te zijn ontstaan. Het is best waarschijnlijk dat peptiden de voorlopers van enzymen zijn geweest.”
Maar waar zit de mogelijke praktische toepassing van dit idee? Die is er ook altijd, zei je eerder.
“De drijfveer hierachter is de grote behoefte aan nieuwe katalysatoren. De industrie zoekt naar duurzame productiemethoden en dat vraagt om nieuwe katalysatoren die veel efficiënter zijn, actief zijn bij lagere temperaturen en geen giftige metalen nodig hebben. Bovendien hebben we nieuwe katalysatoren nodig om de nieuwe producten die we doorlopend ontwikkelen, denk aan materialen of geneesmiddelen, ook op grote schaal te kunnen maken.”
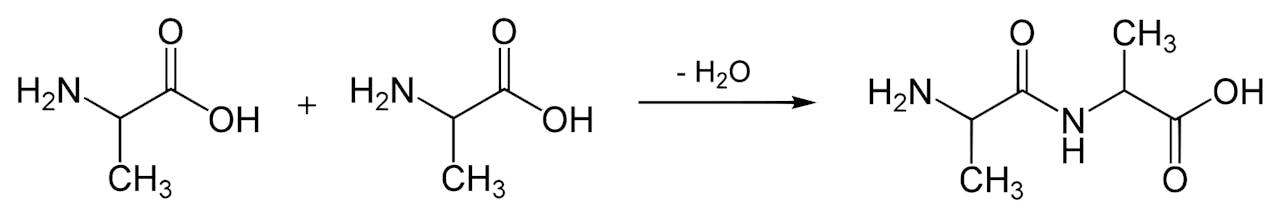
Vorming van de peptidebinding tussen twee alanine moleculen, waardoor een dipeptide ontstaat. Alanine is een van de twintig natuurlijke aminozuren. De OH-groep van het ene molecuul reageert met de NH2 van het andere molecuul, waarbij een watermolecuul (H2O) vrijkomt. Deze reactie is gelijk voor iedere twee aminozuren die aan elkaar binden. Aan beide kanten van dit dipeptide kan weer een aminozuur reageren en zo kan de streng steeds langer worden.
Wikimedia Commons, publiek domeinDus peptiden kunnen wel reacties katalyseren? Hoe hebben jullie dat ontdekt?
“We zijn gaan zoeken naar peptiden die katalytische activiteit vertonen door veel verschillende peptiden te maken en te testen en vervolgens de veelbelovende varianten te laten ‘evolueren’ in het lab. Dat heeft geleid tot een groep tripeptiden, strengetjes van drie aan elkaar gekoppelde aminozuren, die het heel goed doen. We zijn begonnen met peptiden die een zogeheten aldol-reactie kunnen uitvoeren. Bij zo’n reactie vorm je een binding tussen twee koolstofatomen en dat is een van de meest belangrijke stappen als je nieuwe moleculen wilt maken. Onze tripeptiden blijken veel reactiever en selectiever dan de katalysatoren die daar momenteel voor worden gebruikt.”
Maar zijn ze daarmee ook meteen interessant en toepasbaar voor grootschalige processen in de industrie?
“Ik denk van wel, maar dat is iets waar de industriële chemici zich over moeten buigen. Ik wil laten zien dat deze peptiden de potentie hebben om reacties effectief te katalyseren en dan is het aan de bedrijven om de meest geschikte verbindingen te selecteren en verder te optimaliseren voor hun specifieke reacties en processen.”
Weet je ook waarom de tripeptiden beter presteren dan de gangbare katalysatoren?
“Ja, omdat ze veel overeenkomsten vertonen met enzymen en dat zijn de beste katalysatoren die we kennen. Enzymen zijn flexibel en veranderen hun vorm om actief of juist inactief te worden. Dat is compleet anders dan de gangbare katalysatoren in de industrie; die zijn juist ontworpen om heel rigide en vlak te zijn, zodat je een goed beschikbaar oppervlak hebt. Onze tripeptiden blijken echter ook flexibel. De basisstructuur bestaat uit twee keer het aminozuur proline en het derde aminozuur varieert afhankelijk van de reactie die je wilt katalyseren. We hebben uitgebreid gekeken naar de werking van de versie waarbij het derde aminozuur glutamaat is en toen zagen we dat het glutamaat kan bewegen tussen twee posities. Zodra het juiste molecuul voor de reactie in de buurt is, klapt het glutamaat richting dat molecuul om de reactie in te zetten en als dat is voltooid, klapt het weer terug naar de inactieve stand. Onze tripeptiden hebben dus, net als enzymen, een actieve en een inactieve stand waartussen ze variëren door van vorm te veranderen. En in de actieve stand creëren ze een veel gunstiger omgeving voor de reactie dan de starre, industriële katalysatoren.”
Spelen peptiden ook een rol in de andere projecten van je groep?
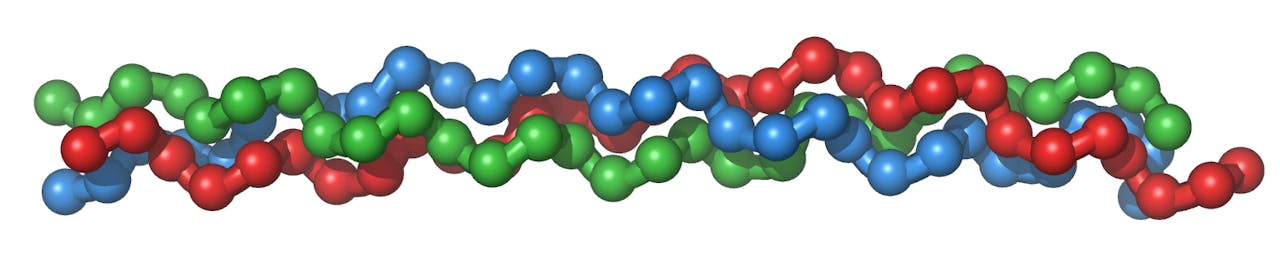
De stevigheid van collageen komt voort uit de drievoudige helix: drie strengen zijn om elkaar gewikkeld. Meerdere helices samen vormen een vezel en meerdere vezels een bundel en zo wordt stapsgewijs een sterke structuur opgebouwd.
Vossman via Wikimedia Commons CC BY SA 3.0“Jazeker. Een ander groot onderwerp in mijn groep is collageen. Dat is een ongelooflijk belangrijk eiwit, ongeveer een derde van de eiwitten in ons lichaam is collageen. Het zorgt voor de stevigheid en elasticiteit van de huid, maar ook van veel andere weefsels. Collageen bestaat uit lange strengen, waarvan er steeds drie om elkaar heen zijn gedraaid tot een stevige helix (‘kurkentrekker’, red.). Maar iedere streng collageen bestaat uit herhalingen van tripeptiden! Om precies te zijn: twee prolines en een glycine, het kleinste aminozuur. Net zoals de tripeptiden in het katalyse project, alleen werken ze nu niet als katalysator, maar zijn ze de bouwstenen van een stevige structuur. Wij willen graag begrijpen hoe collageen precies werkt. Waarom is deze specifieke structuur tijdens de evolutie ontstaan en wat is de functie van die moleculaire bouwstenen? Waarom zitten die daar?”
Dat is dan de fundamentele vraag. En de toepassing? Want collageen wordt al gebruikt in cosmetische en medische producten.

Collageenvezels in een heel dun plakje longweefsel.
Louisa Howard via Wikimedia Commons, publiek domein“Dat klopt, maar daarvoor zijn we nu afhankelijk van dierlijk collageen en dat is niet ideaal. Het kan ongewenste afweerreacties veroorzaken. Menselijk collageen kun je ook opkweken, maar dan weet je niet precies wat je krijgt omdat natuurlijk collageen een mengsel is van vezels en bundeltjes van verschillende lengte en dikte. Dat kun je omzeilen als je synthetisch collageen gebruikt, dus collageen dat je in het laboratorium maakt. Dan heb je controle over de structuur en de samenstelling; je weet precies wat erin zit en hoe het eruit ziet en dat is heel belangrijk voor medische toepassingen. Bovendien kun je er dan gericht nuttige stoffen aan toevoegen zodat je een beter product krijgt. Denk aan bijvoorbeeld pijnstillende of antibacteriële middelen in een collageen-gel die je gebruikt voor wondheling.”
Hoe helpt jullie onderzoek daarbij?
“Wij hebben heel gedetailleerd gekeken naar de rol van de aminozuren in de vorming van de stevige collageen helix. Welke functie hebben die bouwstenen en wat kunnen we veranderen zonder dat we de structuur van collageen verstoren? Want als we nuttige stoffen aan het synthetische collageen willen vastmaken, dan moeten we wel weten waar dat kan. Uiteindelijk hebben we een oplossing gevonden door strengen te maken waarin je drie standaard tripeptiden hebt, dan een tripeptide met aangepast aminozuur en dan weer drie standaard blokken. Het aangepaste aminozuur kun je gebruiken om gericht iets aan te koppelen.
Recent hebben we ook ontdekt dat je een collageen helix van drie verschillende synthetische strengen kunt maken. Dat levert een collageenstructuur die net zo stevig en stabiel is als de natuurlijke variant, maar die wel iets extra’s kan doen. Bijvoorbeeld dat het geheel gevoelig wordt voor de zuurgraad of de temperatuur van de directe omgeving. Meestal is dat bij ontstoken of beschadigd weefsel net iets anders dan bij gezond weefsel. Dat kun je dus gebruiken om op het juiste moment de ingebouwde nuttige stoffen vrij te laten komen. Dit laat voor mij goed zien wat de kern van ons werk is: synthese gebruiken om kleine moleculen iets nuttigs te laten doen wat de natuur niet zelf heeft ontwikkeld.”

