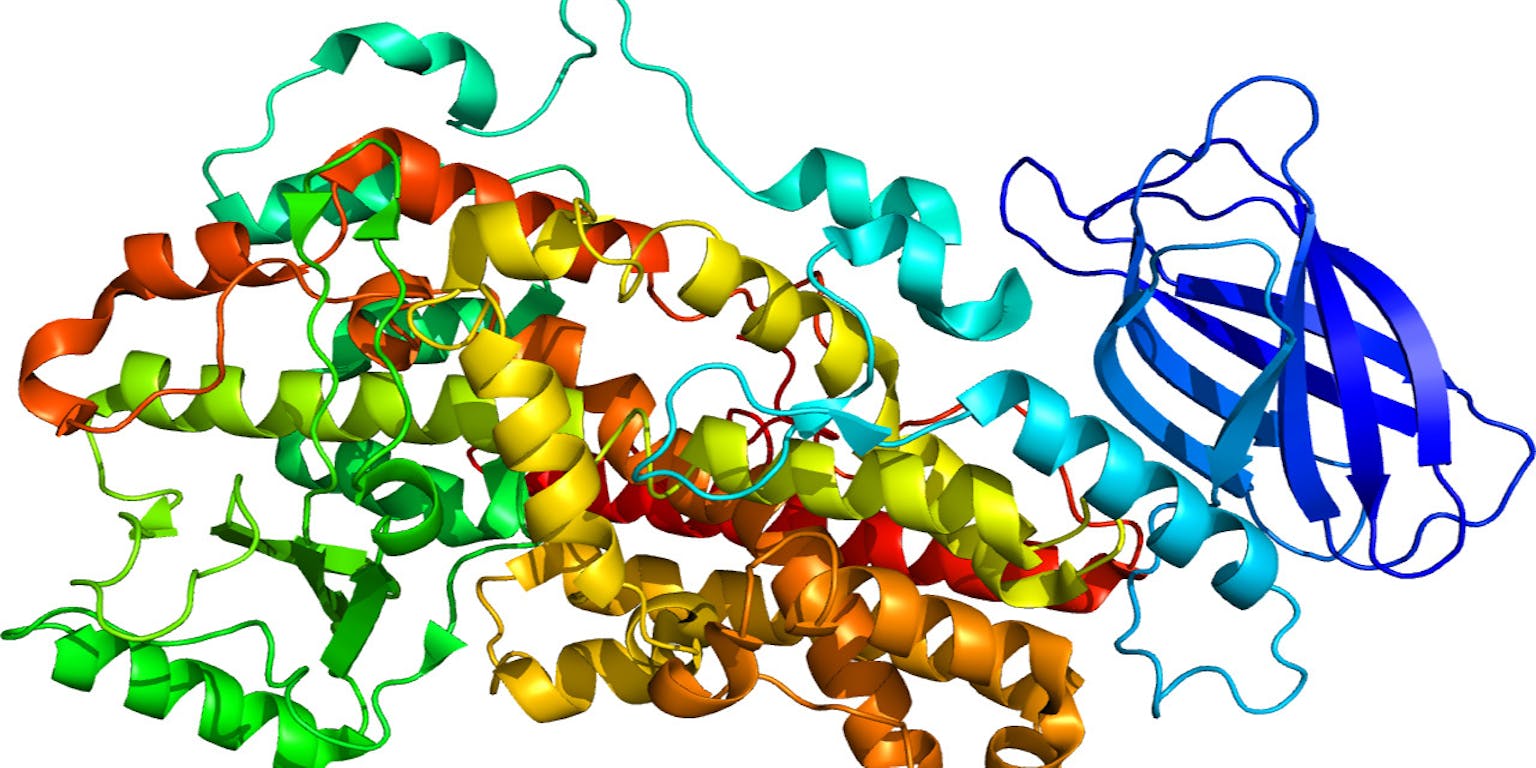
Met een zelflerend algoritme hebben Britse wetenschappers nauwkeurig de driedimensionale vorm van zo’n honderd eiwitten, de bouwstenen van het leven, voorspeld. Met dit nieuwe computerprogramma maken wetenschappers in de toekomst sneller en makkelijker medicijnen.
Sinds de corona-uitbraak ontwikkelen wetenschappers wereldwijd vaccins en medicijnen tegen het coronavirus. In veel gevallen is het doelwit de spijkervormige uitsteeksels op de buitenkant van de ziekteverwekker. Een afbeelding van zo’n spijkereiwit op moleculair niveau helpt wetenschappers om efficiënte medicijnen en een passend vaccin te ontwerpen.
Sleutel om ziekten te bestrijden
Niet alleen ziekteverwekkers, zoals het coronavirus, bestaan uit eiwitten. Ook in het menselijk lichaam zorgen eiwitten ervoor dat alles werkt zoals het hoort. Tenminste, als ze op de juiste manier zijn opgevouwen. De driedimensionale vorm van het eiwit is belangrijk voor zijn functie. Dat is vergelijkbaar met een vliegtuigje gevouwen van papier: één verkeerde vouw en het vliegtuigje heeft nog maar een enkele vleugel en stort direct neer. In ons lichaam leiden zulke verkeerde vouwen tot ziekten zoals taaislijmziekte en de ziekte van Alzheimer.
Om dergelijke ziekten te genezen, is het nuttig om te zien waar het probleem ligt. Net als bij het papieren vliegtuigje dat niet kan vliegen. Dan bekijk je eens goed hoe het vliegtuigje in elkaar zit en hoe het gevouwen is. Wellicht zit er een verkeerde vouw in, die eenvoudig te herstellen is. Op eenzelfde manier helpt een foto van een eiwit onderzoekers te achterhalen waar een eiwit fout opgevouwen is en die fout te herstellen.
Een goede moleculaire afbeelding van een eiwit geeft wetenschappers dus handvatten om ziekten te genezen en ziekteverwekkers te weren. Tot nu toe konden wetenschappers de vorm van eiwitten wel bepalen met technieken in het laboratorium, maar die experimenten zijn duur en kunnen jaren duren.
Wedstrijd vorm voorspellen
Britse wetenschappers gebruikten kunstmatige intelligentie om de vorm van eiwitten te voorspellen. Daarvoor ontwikkelden ze het zelflerend algoritme AlphaFold. De wetenschappers lieten de computer zo’n 170 duizend eiwitvormen zien met hun bijbehorende aminozuurcodes, de bestanddelen van eiwitten. Op basis daarvan leerde de computer hoe eiwitten zichzelf vouwen. De computer heeft nu enkel de aminozuurcode nodig en voorspelt daarmee de vorm van het eiwit binnen enkele dagen of zelfs uren. Omdat zulke aminozuurcodes makkelijk te achterhalen zijn, scheelt dat een hoop tijd.
Met hun voorspellingen wonnen de Britse wetenschappers van het bedrijf DeepMind de veertiende editie van de internationale wedstrijd CASP (Critical Assessment of Structure Prediction). Deze tweejaarlijkse competitie duurt enkele maanden en in die tijd krijgen de wetenschappers steeds de code van een eiwit. Daarvan moet het team de vorm binnen enkele weken voorspellen. Hoe het eiwit er echt uitziet, weet alleen de jury op basis van laboratoriumexperimenten. Zij bekijken hoeveel de voorspelling lijkt op het echte eiwit.
Nog nooit scoorde een team zo hoog als DeepMind. De meeste teams scoorden zo’n 75 van de 100 punten, terwijl DeepMind de 90 haalde. Niet al hun voorspellingen klopten exact, maar bijna twee van iedere drie voorspellingen waren vergelijkbaar met de vorm gevonden in het laboratorium. In sommige gevallen kwam hun voorspelling zelfs precies overeen.
Enorme stap voorwaarts
“Deze nieuwe methode met kunstmatige intelligentie is enorm waardevol”, vindt Ineke Braakman, hoogleraar biochemie aan de universiteit Utrecht. Op dit moment werken veel onderzoekers aan eiwitten zonder precies te weten hoe ze eruit zien. “Als je met de computer de vorm van een eiwit kunt voorspellen, geeft dat handvatten voor experimenten in het lab”, zegt Braakman. Als wetenschappers ongeveer weten hoe de buitenkant van een ziekteverwekker eruitziet, gebruiken wetenschappers dat om vast te stellen waar een medicijn moet binden om hem uit te schakelen.
Aangezien AlphaFold niet alle eiwitvormen correct voorspelt, zullen wetenschappers de informatie combineren met experimenten in het lab. “Het is belangrijk om kritisch te blijven als wetenschapper”, zegt Braakman. Door experimenten weten onderzoekers snel hoe nauwkeurig zo’n voorspelling is.

De deeltjesversneller in Barcelona. Hier gebruiken wetenschappers röntgenstralen om de driedimensionale vorm van eiwitten te achterhalen.
Nicole van 't Wout Hofland voor NEMO Kennislink via CC BY 2.0Ook wetenschapper Roeland Boer noemt de ontwikkeling van het programma AlphaFold positief. Boer werkt in de deeltjesversneller in Barcelona waarbij hij met röntgenstralen de 3D-vorm van eiwitten achterhaalt. “Ik hoop dat ik straks geen werk meer heb”, zegt Boer lachend. “AlphaFold is een enorme sprong in het onderzoek naar eiwitvormen waarmee we een hoop tijd en geld besparen.” Boer heeft zelf ook nog een aantal eiwitten liggen waarvan hij de 3D-vorm niet kan achterhalen met de experimentele methode. Daarvoor wil hij nu graag gebruik maken van het programma.
Open vraagstukken
Hoewel wetenschappers positief zijn over de ontwikkeling van AlphaFold, zien ze ook nog open vraagstukken en ruimte voor verbetering. Het algoritme maakt bijvoorbeeld, net als veel experimentele methoden, een statische foto van een eiwit. Maar een eiwit is beweeglijk: er bestaat niet één 3D-vorm voor een eiwit. Sommige eiwitten trillen zachtjes, terwijl andere werken als een doorgeefluik met twee vormen: open en dicht. Weer andere eiwitten hebben twee ‘benen’ waarmee ze zich lopend verplaatsen en er dus steeds iets anders uitzien. “Ik zou graag zien dat de Britse wetenschappers ook die bewegingen in kaart brengen”, aldus biochemicus Braakman.
Een extra uitdaging zijn grote eiwitmachines. Tot nu toe gebruikten onderzoekers AlphaFold voor een enkel eiwit, maar in de cel vormen zulke eiwitten samen soms een complexe machine. “Het is nog moeilijk om te achterhalen hoe eiwitten aan elkaar binden in zo’n complexe machine”, vertelt Anouk Rijs, hoogleraar Analyse van Biomoleculaire Interacties aan de Vrije Universiteit Amsterdam. Ook daarin kunnen de Britse wetenschappers vervolgstappen nemen.
Bij ziekten zoals Parkinson en Alzheimer vouwen eiwitten in het lichaam zich verkeerd op, waardoor ze aan elkaar plakken en ophopingen vormen. “Het is een mooie uitdaging voor AlphaFold om dit mechanisme te begrijpen”, vindt Rijs. Met meer kennis over zulke verkeerd gevouwen en opgehoopte eiwitten, kunnen onderzoekers gerichter een oplossing en medicijnen vinden voor deze ziekten.
Computervoorspelling
Ondanks enkele open vraagstukken gaan wetenschappers wereldwijd al aan de slag met voorspellingen van AlphaFold. Daarmee ontwikkelen ze straks bijvoorbeeld sneller medicijnen. Hoewel er een kritische blik nodig blijft, zal het Europees Geneesmiddelenbureau (EMA) medicijnen niet afkeuren omdat ze gebaseerd zijn op een voorspelling. “Grofweg stelt het EMA twee eisen aan een nieuw medicijn”, vertelt biochemicus Braakman. “Het moet werken en het moet veilig zijn.” Dus als een nieuw medicijn aan die criteria voldoet, maakt het niet uit hoe het tot stand gekomen is.

Van veel medicijnen weten onderzoekers niet hoe ze precies werken.
Photo by freestocks.org on UnsplashOok verwacht Braakman dat AlphaFold farmaceuten helpt om bestaande medicijnen beter te begrijpen. Juist omdat de criteria van het EMA draaien om werkzaamheid en veiligheid, weten onderzoekers niet altijd hoe een medicijn precies werkt. Bijvoorbeeld het medicijn tegen de erfelijke taaislijmziekte. Daarbij vouwt een eiwit in het lichaam zich verkeerd op, waardoor het slijm in de longen, keel en darmen dik en taai wordt. “Door de vorm van het verkeerd gevouwen eiwit te bestuderen, hopen we te begrijpen hoe het medicijn werkt”, verklaart Braakman. Mogelijk ontdekken onderzoekers dan ook dat sommige medicijnen werken tegen meerdere ziekten.
Ook ziekteverwekkers zoals bacteriën en virussen bestrijden gaat naar verwachting straks makkelijker met AlphaFold. Wellicht brengt de kunstmatige intelligentie bij een volgende epidemie de eiwitten van de ziekteverwekker binnen enkele dagen in kaart en liggen de medicijnen sneller op de plank.